Orbitales hybrides : La liaison dans les molécules complexes et les problèmes pratiques
- Page ID
- 126822
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Formation de liaisons sigma : la molécule H2
Le cas le plus simple à considérer est celui de la molécule d'hydrogène, H2. Lorsque nous disons que les deux électrons de chacun des atomes d'hydrogène sont partagés pour former une liaison covalente entre les deux atomes, ce que nous voulons dire en termes de théorie de liaison de valence est que les deux orbitales sphériques 1s se recouvrent, permettant aux deux électron de former une paire entre les deux orbitales qui se recouvrent.

Ces deux électrons sont maintenant attirés par la charge positive des deux noyaux d'hydrogène, ce qui fait qu'ils servent en quelque sorte de " colle chimique " maintenant les deux noyaux ensemble.
Liaison dans le méthane
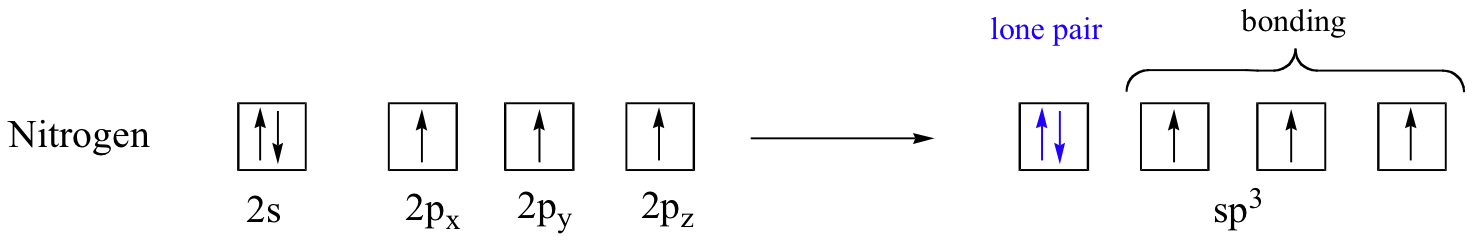
Passons maintenant au méthane, la molécule organique la plus simple. Rappeler la configuration des électrons de valence du carbone central :
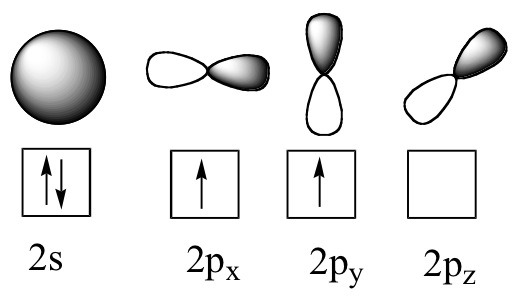
Cette situation est toutefois problématique. Comment le carbone forme-t-il quatre liaisons s'il n'a que deux orbitales p à moitié remplies disponibles pour la liaison ? Un indice vient de l'observation expérimentale que les quatre liaisons C-H dans le méthane sont disposées avec une géométrie tétraédrique autour du carbone central, et que chaque liaison a la même longueur et résistance. Pour expliquer cette observation, la théorie de l'obligation de valence s'appuie sur un concept appelé hybridation orbitale. Dans cette image, les quatre orbitales de valence du carbone (une de 2s et trois de 2p) se combinent mathématiquement (rappelez-vous : les orbites sont décrites par des équations) pour former quatre orbitales hybrides équivalentes, qui sont appelées orbitales sp3 car elles sont formées en mélangeant une s et trois p orbitales. Dans la nouvelle configuration électronique, chacun des quatre électrons de valence du carbone occupe une seule orbitale sp3.

Les orbitales hybrides sp3, comme les p orbitales dont elles sont partiellement composées, sont de forme oblongue, et ont deux lobes de signe opposé. Contrairement aux p orbitales, cependant, les deux lobes sont de taille très différente. Les lobes plus grands des hybrides sp3 sont dirigés vers les quatre coins d'un tétraèdre, ce qui signifie que l'angle entre deux orbites est de 109,5o.
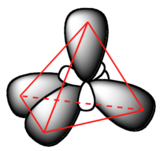
Cette géométrie est tout à fait logique si l'on considère que c'est précisément cet angle qui permet aux quatre orbitales (et aux électrons qu'elles contiennent) d'être aussi éloignées les unes des autres que possible, ce qui est une simple reformulation de la théorie de la répulsion des paires d'électrons de la couche de valence (RPECV) que vous avez appris en chimie générale : les paires d'électrons (en orbitale) vont se placer aussi loin que possible, grâce au repoussement électrostatique négatif-notamment négatif.
Chaque liaison C-H dans le méthane peut donc être décrite comme un recouvrement entre une orbitale 1s à moitié remplie dans un atome d'hydrogène et le lobe plus grand d'une des quatre orbitales hybrides sp3 à moitié remplies dans le carbone central. La longueur des liaisons carbone-hydrogène dans le méthane est de 1,09 Å (1,09 x 10-10 m).
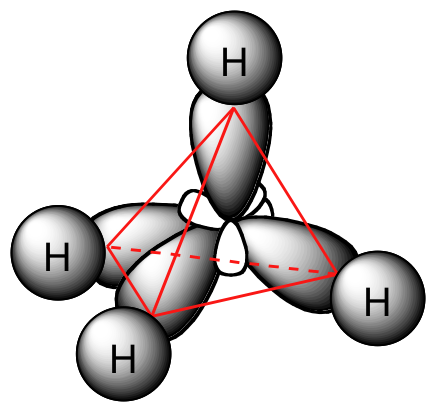
Alors qu'auparavant nous avions dessiné une structure de Lewis du méthane en deux dimensions en utilisant des lignes pour désigner chaque liaison covalente, nous pouvons maintenant dessiner une structure plus précise en trois dimensions, montrant la géométrie de liaison tétraèdre. Pour le faire sur une page bidimensionnelle, nous devons cependant introduire une nouvelle convention de dessin : le système de cale solide/en pointillés. Dans cette convention, un coin solide représente simplement un lien qui est censé être représenté émergeant du plan de la page. Un coin en pointillés représente un lien qui est destiné à être représenté en pointant dans ou derrière le plan de la page. Les lignes normales impliquent des liens qui se trouvent dans le plan de la page.
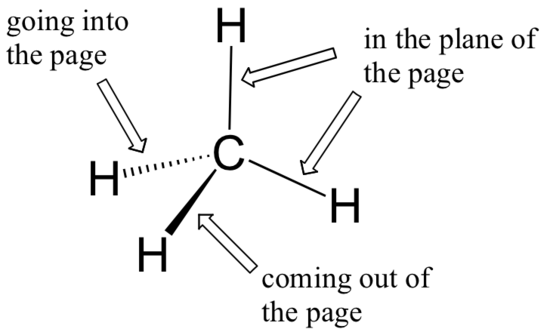
Ce système prend un peu de temps à s'habituer, mais avec un peu de pratique, votre œil apprendra immédiatement à " voir " la troisième dimension représentée.
| EXEMPLE |
|---|
|
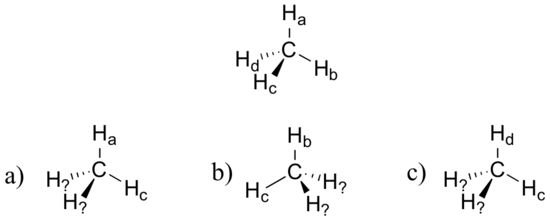
Imaginez que vous pourriez distinguer les quatre hydrogènes d'une molécule de méthane et les étiqueter de Ha à Hd. Dans les images ci-dessous, la même molécule de méthane est tournée et retournée dans différentes positions. Dessinez les étiquettes manquantes de l'atome d'hydrogène. (Il sera beaucoup plus facile de le faire si vous faites un modèle.)
|
| EXEMPLE |
|---|
|
Décrire, à l'aide d'une image et de mots, la liaison en chloroforme, CHCl3. |
Le système de liaison est également tétraédrique : les trois liaisons N-H de l'ammoniac peuvent être représentées comme formant la base d'une pyramide trigonale, la quatrième est orbitale, contenant la paire unique, formant la partie supérieure de la pyramide.
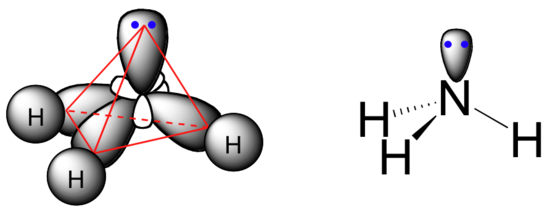
Rappelez-vous de votre étude de la théorie RPECV en Chimie Générale que la paire isolée, avec son effet répulsif légèrement plus important, " pousse " les trois sbonds N-H du haut de la pyramide, ce qui signifie que les angles de liaison H-N-H sont légèrement inférieurs à ceux du tétraèdre, à 107,3˚ au lieu de 109,5˚
La théorie RPECV prédit également, avec précision, qu'une molécule d'eau est " pliée " à un angle d'environ 104. 5˚ Il semblerait donc logique de décrire la liaison dans l'eau comme se produisant par le recouvrement des orbitales hybrides sp3 sur l'oxygène et 1s orbitals sur les deux atomes d'hydrogène. Dans ce modèle, les deux paires isolées sans liaison sur l'oxygène seraient situées dans des orbitales sp3.

Certaines preuves expérimentales, cependant, suggèrent que les orbitales de liaison sur l'oxygène sont en fait des orbitales 2p non hybridés plutôt que des hybrides sp3. Bien que cela semble impliquer que l'angle de liaison H-O-H devrait être 90˚ (rappelez-vous que les p orbites sont orientées perpendiculairement les unes aux autres), il semble que la répulsion électrostatique a pour effet de déformer cet angle p-orbital à 104. 5˚ Le modèle orbital hybride et le modèle orbital non hybride présentent tous deux des explications raisonnables pour l'arrangement de liaison observé dans l'eau, de sorte que nous ne nous intéresserons pas davantage à cette distinction.
| Example |
|---|
|
Dessiner, dans le même style que les figures ci-dessus, une image orbitale pour la liaison en méthylamine.
|
Formation de liaisons pi - hybridation sp2 et sp
La théorie de la liaison de valence, avec le concept orbitale hybride, décrit très bien les composés à double liaison comme l'éthène. Trois caractéristiques expérimentalement observables de la molécule d'éthène doivent être prises en compte par un modèle de liaison :
- L'éthène est une molécule plane (plate).
- Les angles de liaison dans l'éthène sont d'environ 120o et la longueur de la liaison carbone-carbone est de 1,34 Å, beaucoup plus courte que la liaison simple carbone-carbone de 1,54 Å de l'éthane.
- Il existe un obstacle important à la rotation autour de la double liaison carbone-carbone.
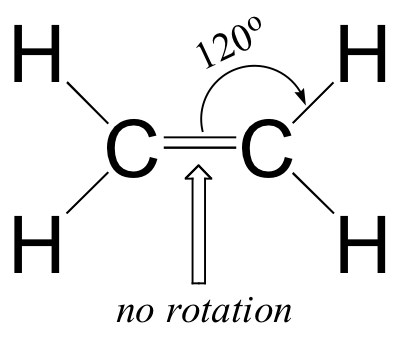
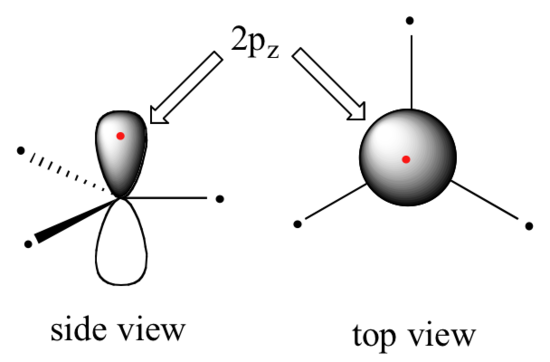
Il est clair que ces caractéristiques ne correspondent pas à une image de liaison hybride sp3 pour les deux atomes de carbone. Au lieu de cela, la liaison dans l'éthène est décrite par un modèle impliquant la participation d'un autre type d'orbitale hybride. Trois orbitales atomiques sur chaque carbone - les orbitales 2s, 2px et 2py - se combinent pour former trois hybrides sp2, laissant l'orbitale 2pz non hybridée.

Les trois hybrides sp2 sont disposés avec une géométrie planaire trigonale, pointant vers les trois coins d'un triangle équilatéral, avec des angles de 120° entre eux. L'orbitale non hybridée de 2pz est perpendiculaire à ce plan (dans les figures suivantes, les orbitales sp2 et les liaisons sigma auxquelles elles contribuent sont représentées par des lignes et des coins ; seules les orbitales de 2pz sont représentées en mode "remplissage spatial").
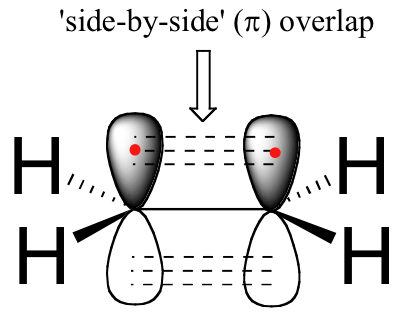
La double liaison carbone-carbone dans l'éthène se compose d'une liaison, formée par le recouvrement de deux orbitales sp2, et d'une seconde liaison, appelée liaison π (pi), qui est formée par le recouvrement côte à côte des deux orbitales 2pz non hybridée de chaque carbone.
spacefilling image of bonding in ethene
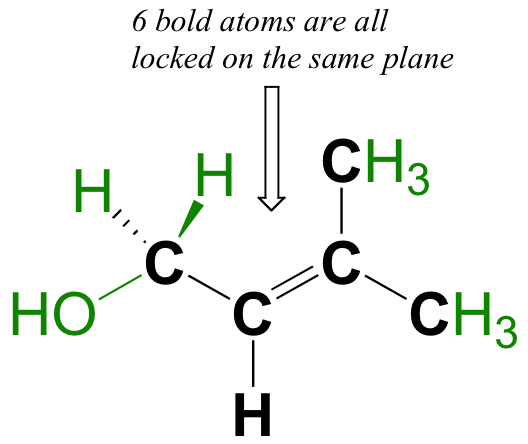
La liaison pi n'a pas de symétrie symétrique. Parce qu'ils sont le résultat d'un recouvrement côte à côte (plutôt que d'un recouvrement de bout en bout comme une liaison sigma), les liaisons pi ne sont pas libres de tourner. Si une rotation autour de cette liaison devait se produire, cela impliquerait de perturber le recouvrement côte à côte entre les deux orbitales de 2pz qui composent la liaison pi. La présence du lien pi " enferme " ainsi les six atomes d'éthène dans le même plan. Cet argument s'étend aux grands groupes alcène : dans chaque cas, les six atomes du groupe forment un plan unique.
| EXEMPLE |
|---|
|
Encerclez les six atomes de la molécule ci-dessous qui sont " enfermés " dans le même plan.
|
| Example |
|---|
| Quels types d`orbitales se recouvrent dans les obligations a-d indiquées ci-dessous ?
|
| EXEMPLE |
|---|
|
Qu'est-ce qui ne va pas avec la façon dont la structure suivante est dessinée ?
|
Une image similaire peut être dessinée pour la liaison dans les groupes carbonyles, tels que le formaldéhyde. Dans cette molécule, le carbone est hybridé sp2, et nous supposerons que l'atome d'oxygène est également hybridé sp2. Le carbone a trois liaisons sigma : deux sont formées par recouvrement entre deux de ses orbitales sp2 et l'orbitale 1 de chacun des hydrogènes, et la troisième liaison sigma est formée par recouvrement entre l'orbitale sp2 de carbone restant et une orbitale sp2 de l'oxygène. Les deux paires solitaires sur oxygène occupent ses deux autres orbitales sp2.
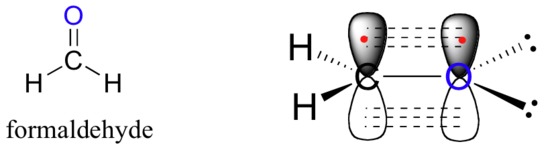
La liaison pi est formée par le recouvrement côte à côte des orbitales non hybridées de 2pz sur le carbone et l'oxygène. Tout comme dans les alcènes, les orbitales 2pz qui forment la liaison pi sont perpendiculaires au plan formé par les liaisons sigma.
| EXEMPLE |
|---|
|
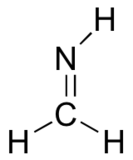
Décris et dessine l'image de liaison pour le groupe imine illustré ci-dessous. Utilisez le dessin du formaldéhyde ci-dessus comme guide.
|
Contributeurs
- Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)