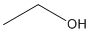Structures et formules des molécules organiques
- Page ID
- 126823
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
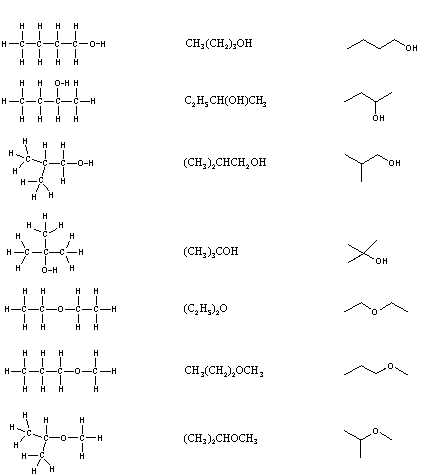
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Il est nécessaire de dessiner des formules structurales pour les composés organiques car, dans la plupart des cas, une formule moléculaire ne représente pas uniquement un seul composé. Différents composés ayant la même formule moléculaire sont appelés isomères, et la prévalence des isomères organiques reflète l'extraordinaire polyvalence du carbone à former des liens solides avec lui-même et avec d'autres éléments. Lorsque le groupe d'atomes qui composent les molécules de différents isomères est lié entre eux de manières fondamentalement différentes, nous appelons ces composés des isomères constitutionnels. Il existe sept isomères constitutionnels de C4H10O, dont les formules structurelles sont présentées dans le tableau suivant. Ces formules représentent tous les composés C4H10O connus et possibles et présentent une caractéristique structurelle commune. Il n'y a pas de doubles ou triples liaisons ni d'anneaux dans aucune de ces structures.
Formules structurales pour les isomères C4H10O
| Formule Kekulé | Formule condensée | Formule abrégée |
 |
||
La simplification des formules structurelles peut être réalisée sans perte de l'information qu'elles transmettent. Dans les formules structurales condensées, les liaisons à chaque carbone sont omises, mais chaque unité structurale distincte (groupe) est écrite avec des numéros d'indice désignant des substituants multiples, y compris les hydrogènes. Les formules abrégées omettent complètement les symboles du carbone et de l'hydrogène. Chaque segment de ligne droite représente une liaison, les extrémités et les intersections des lignes sont des atomes de carbone, et le nombre correct d'hydrogènes est calculé à partir de la tétravalence du carbone. Les électrons de valence sans liaison sont omis dans ces formules.
Développer la capacité de visualiser une structure tridimensionnelle à partir de formules bidimensionnelles exige de la pratique et, dans la plupart des cas, l'aide de modèles moléculaires. Comme nous l'avons déjà mentionné, les étudiants et les chimistes professionnels ont accès à de nombreux modèles de trousses, et les étudiants débutants sont encouragés à s'en procurer une.
Formule Kekulé
Une formule structurelle affiche les atomes de la molécule dans l'ordre dans lequel ils sont liés. Il décrit également comment les atomes sont liés les uns aux autres, par exemple par une simple, double ou triple liaison covalente. Les liaisons covalentes sont représentées par des lignes. Le nombre de tirets indique si la liaison est simple, double ou triple. Les formules structurelles sont utiles parce qu'elles expliquent les propriétés et la structure du composé que les formules empiriques et moléculaires ne peuvent pas toujours représenter.
Formule condensée
Les formules structurales condensées montrent l'ordre des atomes comme une formule structurale mais sont écrites en une seule ligne pour gagner de l'espace et le rendre plus pratique et plus rapide à écrire. Les formules structurales condensées sont également utiles pour montrer qu'un groupe d'atomes est relié à un seul atome dans un composé. Quand cela se produit, les parenthèses sont utilisées autour du groupe d'atomes pour montrer qu'ils sont ensemble.
Ex. Formule structurelle condensée pour l'éthanol : CH3CH2CH2OH (Formule moléculaire pour l'éthanol C2H6O).
Formule abrégée
Parce que les composés organiques peuvent parfois être complexes, les formules d'angle de ligne sont utilisées pour écrire les atomes de carbone et d'hydrogène plus efficacement en remplaçant les lettres par des lignes. Un atome de carbone est présent partout où une ligne croise une autre ligne. Les atomes d'hydrogène sont alors supposés compléter chacune des quatre liaisons du carbone. Tous les autres atomes qui sont reliés à des atomes de carbone sont écrits. Les formules d'angle de ligne aident à montrer la structure et l'ordre des atomes dans un composé, ce qui rend les avantages et les inconvénients similaires aux formules structurelles.
Ex. Formule abrégée pour l'éthanol :
Contributors
- Jean Kim (UCD), Kristina Bonnett (UCD)