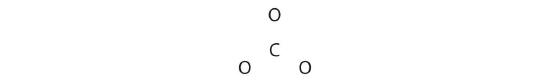Structures de résonance
- Page ID
- 126819
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Structures de résonance
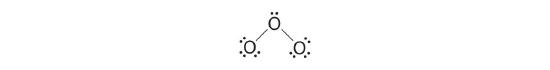
Parfois, même lorsqu'on tient compte des charges formelles, la liaison de certaines molécules ou ions ne peut être décrite par une seule structure de Lewis. C'est le cas de l'ozone (O3), un allotrope d'oxygène avec une structure en V et un angle O-O-O de 117,5°.
1. Nous savons que l'ozone a une structure en forme de V, donc un atome d'O est central :
2. Chaque atome O possède 6 électrons de valence, pour un total de 18 électrons de valence.
3. Attribuer une paire d'électrons de liaison à chaque liaison oxygène-oxygène donne
avec 14 électrons qui restent.
4. Si nous plaçons trois paires d'électrons isolées sur chaque oxygène terminal, nous obtenons
et qu'il reste 2 électrons.
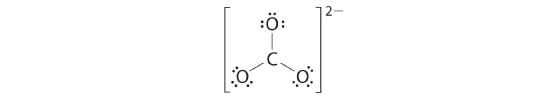
5. À ce stade, les deux atomes d'oxygène terminaux ont des octets d'électrons. Nous plaçons donc les 2 derniers électrons sur l'atome central :
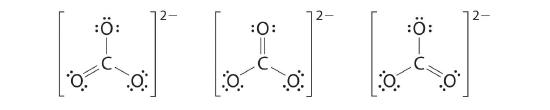
6. L'oxygène central n'a que 6 électrons. Nous devons convertir une paire isolée sur un atome d'oxygène terminal en une paire d'électrons de liaison - mais laquelle ? Selon celui que nous choisissons, nous obtenons soit
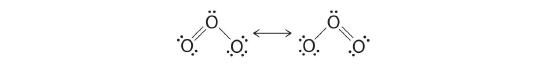
Lequel est correct ? En fait, ni l'un ni l'autre n'est correct. Les deux prédisent une liaison simple O-O et une liaison double O=O. Si les liens étaient de types différents (un simple et un double, par exemple), ils auraient des longueurs différentes. Il s'avère, cependant, que les deux distances de liaison O-O sont identiques, 127,2 pm, ce qui est plus court qu'une liaison simple O-O typique (148 pm) et plus long que la double liaison O=O en O2 (120,7 pm).
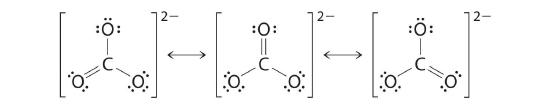
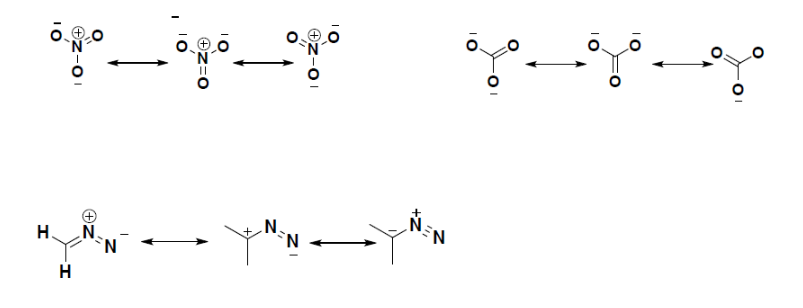
Les structures équivalentes à points de Lewis, comme celles de l'ozone, sont appelées structures de résonance. La position des atomes est la même dans les différentes structures de résonance d'un composé, mais la position des électrons est différente. Des flèches à deux têtes relient les différentes structures de résonance d'un composé :
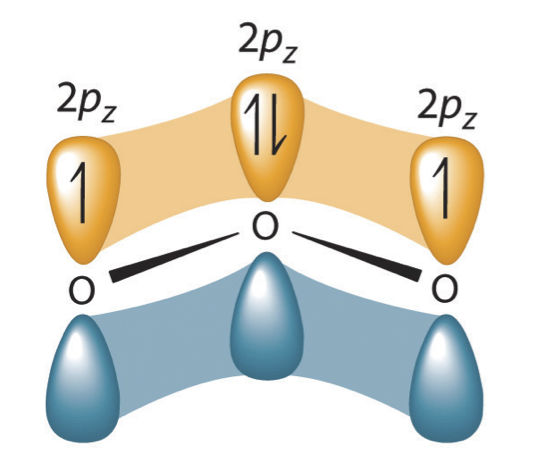
Avant le développement de la chimie quantique, on pensait que la flèche à double tête indiquait que la structure électronique réelle est une moyenne des structures représentées, ou que la molécule oscille entre les deux structures. Aujourd'hui, nous savons que les électrons impliqués dans les doubles liaisons occupent une orbitale qui s'étend sur les trois molécules d'oxygène, combinant p orbitales sur les trois.
Figure 5.3.4 La structure de résonance de l'ozone implique une orbitale moléculaire qui s'étend sur les trois atomes d'oxygène. Dans l'ozone, une orbitale moléculaire s'étendant sur les trois atomes d'oxygène est formée à partir de trois orbitales pz centrées sur l'atome. Des orbitales moléculaires similaires se trouvent dans chaque structure de résonance.![]()
Notez le motif
Lorsqu'il est possible d'écrire plus d'une structure de résonance équivalente pour une molécule ou un ion, la structure réelle implique une orbitale moléculaire qui est une combinaison linéaire des orbitales atomiques de chacun des atomes.
CO32−
Comme l'ozone, la structure électronique de l'ion carbonate ne peut être décrite par une seule structure électronique de Lewis. Contrairement à O3, cependant, les structures de Lewis décrivant CO32- ont trois représentations équivalentes.
1. Parce que le carbone est l'élément le moins électronégatif, nous le plaçons en position centrale :
2. Le carbone a 4 électrons de valence, chaque oxygène a 6 électrons de valence, et il y en a 2 autres pour la charge -2. Cela donne 4 + (3 × 6) + 2 = 24 électrons de valence.
3. Six électrons sont utilisés pour former trois paires de liaison entre les atomes d'oxygène et le carbone :
4. Nous divisons les 18 électrons restants également entre les trois atomes d'oxygène en plaçant trois paires solitaires sur chacun d'eux et en indiquant la charge -2 :
5. Il ne reste plus d'électrons pour l'atome central.
6. À ce stade, l'atome de carbone n'a que 6 électrons de valence, nous devons donc prendre une paire unique d'un atome d'oxygène et l'utiliser pour former une double liaison carbone-oxygène. Dans ce cas, cependant, il y a trois choix possibles :
Comme pour l'ozone, aucune de ces structures ne décrit exactement la liaison. Chacun prévoit une double liaison carbone-oxygène et deux simples liaisons carbone-oxygène, mais expérimentalement toutes les longueurs de liaison C-O sont identiques. Nous pouvons écrire des structures de résonance (dans ce cas, trois d'entre elles) pour l'ion carbonate :
Comme dans le cas de l'ozone, la structure réelle implique la formation d'une orbite moléculaire à partir d'orbitales pz centrées sur chaque atome et situées au-dessus et au-dessous du plan de l'ion CO32-. ![]()
EXEMPLE
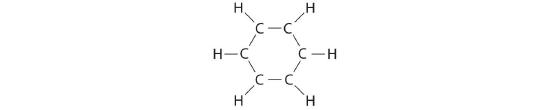
Le benzène est un solvant organique courant qui était auparavant utilisé dans l'essence ; toutefois, il n'est plus utilisé à cette fin, car on sait maintenant qu'il est cancérigène. La molécule de benzène (C6H6) est constituée d'un hexagone régulier d'atomes de carbone, dont chacun est également lié à un atome d'hydrogène. Utiliser des structures de résonance pour décrire la liaison dans le benzène.
Données : formule moléculaire et géométrie moléculaire
Demande demandée : structures de résonance
Stratégie :
1. Dessinez une structure pour le benzène illustrant les atomes liés. Calculez ensuite le nombre d'électrons de valence utilisés dans ce dessin.
2. Soustrayez ce nombre du nombre total d'électrons de valence dans le benzène et localisez ensuite les électrons restants de sorte que chaque atome de la structure atteigne un octet.
A. Dessiner les structures de résonance du benzène.
Solution :
Chaque atome de carbone dans cette structure n'a que 6 électrons et a une charge formelle de +1, mais nous n'avons utilisé que 24 des 30 électrons de valence.
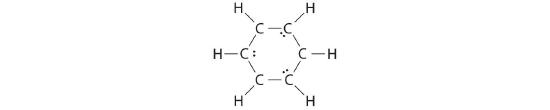
B Si les 6 électrons restants sont uniformément répartis par paires sur des atomes de carbone alternatifs, on obtient ce qui suit :
Trois atomes de carbone ont maintenant une configuration en octet et une charge formelle de -1, tandis que trois atomes de carbone ont seulement 6 électrons et une charge formelle de +1. Nous pouvons convertir chaque paire isolée en une paire d'électrons de liaison, ce qui donne à chaque atome un octet d'électrons et une charge formelle de 0, en faisant trois doubles liaisons C=C.
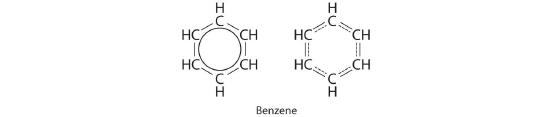
C Il y a cependant deux façons d'y parvenir :
Chaque structure a des liaisons simples et doubles alternées, mais l'expérimentation montre que chaque liaison carbone-carbone dans le benzène est identique, avec des longueurs de liaison (139,9 pm) intermédiaires entre celles que l'on trouve généralement pour une simple liaison C-C (154 pm) et une double liaison C=C (134 pm). Nous pouvons décrire la liaison dans le benzène en utilisant les deux structures de résonance, mais la structure électronique réelle est une moyenne des deux. L'existence de structures de résonance multiples pour les hydrocarbures aromatiques comme le benzène est souvent indiquée en traçant un cercle ou des lignes pointillées à l'intérieur de l'hexagone :
Cette combinaison de p orbitales pour le benzène peut être visualisée comme un anneau avec un noeud dans le plan des atomes de carbone.
PROBLÈME DE PRATIQUE
Le sel de sodium de nitrite est utilisé pour soulager les spasmes musculaires. Dessiner deux structures de résonance pour l'ion nitrite (NO2-).
Réponse :
Les structures de résonance sont particulièrement fréquentes dans les oxoanions des éléments du bloc p, comme le sulfate et le phosphate, et dans les hydrocarbures aromatiques, comme le benzène et le naphtalène.
Règles d'estimation de la stabilité des structures de résonance
- Plus le nombre de liaisons covalentes est élevé, plus la stabilité est grande puisque plus d'atomes auront des octets complets.
- La structure avec le moins grand nombre de charges formelles est plus stable
- La structure avec le moins de séparation de la charge formelle est plus stable
- Une structure avec une charge négative sur l'atome électronégatif le plus électronégatif sera plus stable.
- Les charges positives sur l'atome le moins électronégatif (le plus électropositif) sont plus stables.
- Les formes de résonance équivalentes n'ont pas de différence de stabilité et contribuent également. (p. ex. benzène)
Les structures de résonance ci-dessus montrent que les électrons sont délocalisés à l'intérieur de la molécule et par ce processus, la molécule gagne en stabilité supplémentaire. L'ozone avec ses deux charges opposées crée une molécule neutre et par résonance c'est une molécule stable. L'électron supplémentaire qui a créé la charge négative sur l'oxygène terminal peut être délocalisé par résonance à travers les oxygènes terminaux.
Le benzène est une molécule extrêmement stable, dont la géométrie et l'interaction orbitale moléculaire s'expliquent, mais surtout par ses structures de résonance. Les électrons délocalisés dans le cycle benzénique rendent la molécule très stable et avec ses caractéristiques de nucléophile, elle ne réagira qu'avec un électrophile fort et après la première réactivité, le benzène substitué dépendra de sa résonance pour diriger la position suivante pour que la réaction ajoute un second substituant.
La molécule suivante, l'amide, est une molécule très stable qui est présente dans la plupart des systèmes biologiques, principalement dans les protéines. Par des études de spectroscopie RMN et de cristallographie aux rayons X, il est confirmé que la stabilité de l'amide est due à la résonance qui, par interaction orbitale moléculaire, crée presque une double liaison entre l'azote et le carbone.
| Exemple : Résonance multiple d'autres molécules |
|---|
|
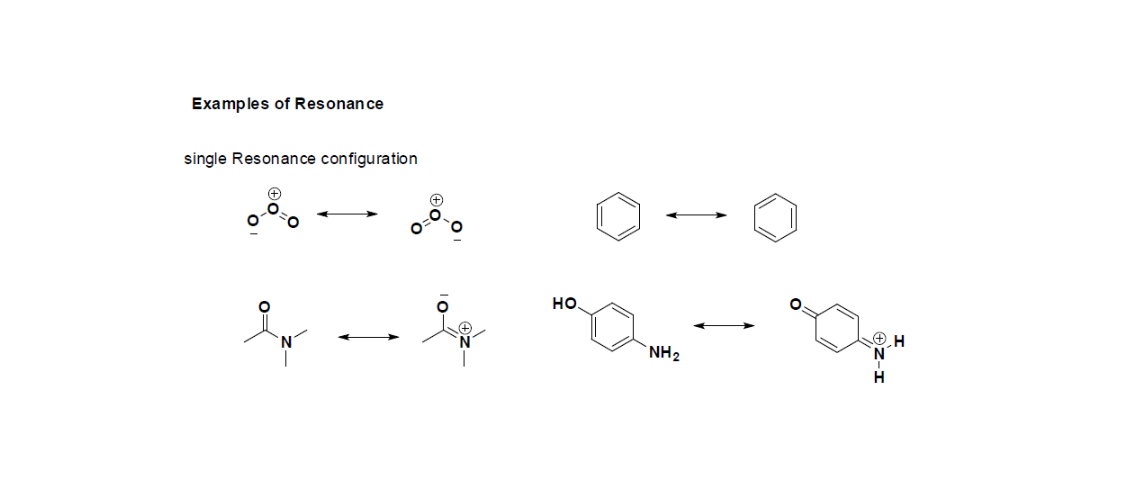
Molécules ayant plus d'une forme de résonance
Certaines conformations de résonance structurale sont les principaux contributeurs ou les formes dominantes de l'existence de la molécule. Par exemple, si nous examinons les règles ci-dessus pour estimer la stabilité d'une molécule, nous constatons que pour la troisième molécule, les première et deuxième formes sont les principaux contributeurs de la stabilité globale de la molécule. L'azote est plus électronégatif que le carbone, donc il peut supporter la charge négative plus que le carbone. Un carbone avec une charge négative est la conformation la moins favorable à l'existence de la molécule, donc la dernière forme de résonance contribue très peu à la stabilité de l'ion.
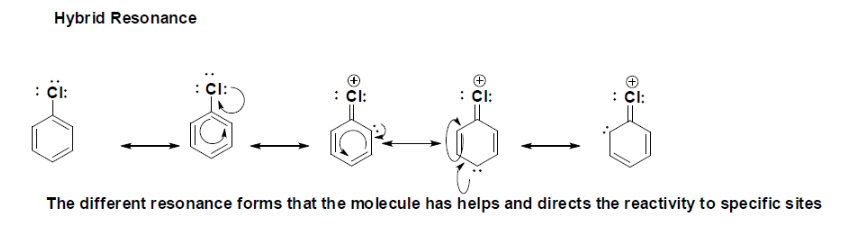
Les formes de résonance hybride montrent les différentes structures de Lewis avec l'électron délocalisé. Ceci est très important pour la réactivité du chloro-benzène car en présence d'un électrophile, il réagit et la formation d'une autre liaison est dirigée et déterminée par résonance. La longue paire d'électrons délocalisés dans le noyau aromatique substitué est l'endroit où elle peut potentiellement former une nouvelle liaison avec un électrophile, car il est démontré qu'il y a trois endroits possibles où la réactivité peut avoir lieu, le premier à réagir aura lieu en position para par rapport au substituant chloro et ensuite en position ortho. |
Contributors
- Sharon Wei (UCD), Liza Chu (UCD)