Les liaisons ioniques et covalentes - La règle de l`octet
- Page ID
- 126817
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Il existe de nombreux types de liaisons et de forces chimiques qui lient les molécules ensemble. Les deux types de liaisons les plus élémentaires sont les liaisons ionique ou covalente. Dans la liaison ionique, les atomes transfèrent des électrons les uns aux autres. Les liaisons ioniques requièrent au moins un donneur d'électrons et un accepteur d'électrons. En revanche, les atomes ayant la même électronégativité partagent des électrons dans des liaisons covalentes, parce qu'aucun des deux atomes n'attire ou ne répulse de préférence les électrons qu'il partage.
Introduction
La liaison ionique est le transfert complet d'électron(s) de valence entre atomes. C'est un type de liaison chimique qui génère deux ions chargés en sens inverse. Dans les liaisons ioniques, le métal perd des électrons pour devenir un cation chargé positivement, alors que le non-métal les accepte pour devenir un anion chargé négativement. Les liaisons ioniques nécessitent un donneur d'électrons, souvent un métal, et un accepteur d'électrons, un non-métal.
La liaison ionique est observée parce que les métaux ont peu d'électrons dans leurs orbites les plus extérieures. En perdant ces électrons, ces métaux peuvent obtenir une configuration de gaz noble et satisfaire à la règle de l'octet. De même, les non-métaux qui ont près de 8 électrons dans leur couche de valence ont tendance à accepter facilement des électrons pour obtenir une configuration de gaz noble. En liaison ionique, plus d'un électron peut être donné ou reçu pour satisfaire à la règle de l'octet. Les charges sur l'anion et le cation correspondent au nombre d'électrons donnés ou reçus. Dans les liaisons ioniques, la charge nette du composé doit être zéro.
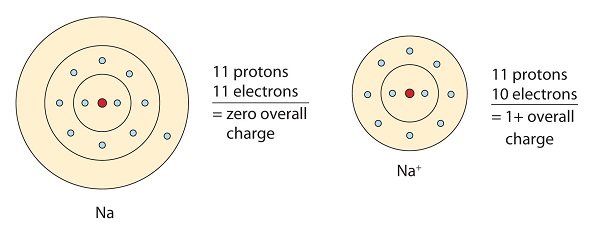
Cette molécule de sodium donne l'électron seul dans son orbite de valence afin d'obtenir une configuration octet. Cela crée un cation chargé positivement en raison de la perte d'électrons.
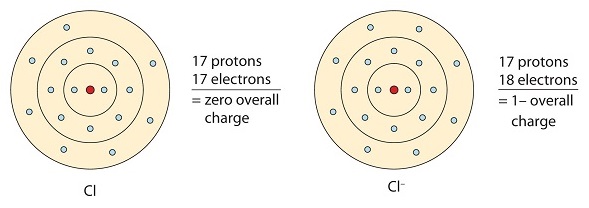
Cet atome de chlore reçoit un électron pour atteindre sa configuration octet, ce qui crée un anion chargé négativement.
L'énergie globale prévue du processus de liaison ionique, qui comprend l'énergie d'ionisation du métal et l'affinité électronique du non métal, est généralement positive, ce qui indique que la réaction est endothermique et défavorable. Cependant, cette réaction est très favorable en raison de l'attraction électrostatique entre les particules. À la distance interatomique idéale, l'attraction entre ces particules libère suffisamment d'énergie pour faciliter la réaction. La plupart des composés ioniques ont tendance à se dissocier dans les solvants polaires parce qu'ils sont souvent polaires. Ce phénomène est dû aux charges opposées sur chaque ion.
EXEMPLE : SELS DE CHLORe
.jpg?revision=2)
Dans cet exemple, l'atome de sodium donne son électron de 1 valence à l'atome de chlore. Cela crée un cation sodium et un anion chlore. Notez que la charge nette du composé résultant est de 0.
Dans cet exemple, l'atome de magnésium donne ses deux électrons de valence à des atomes de chlore. Chaque atome de chlore ne peut accepter qu'un seul électron avant d'atteindre sa configuration de gaz noble ; donc, 2 atomes de chlore sont nécessaires pour accepter les 2 électrons donnés par le magnésium. Notez que la charge nette du composé est de 0.
Liaison covalente
La liaison covalente est le partage des électrons entre les atomes. Ce type de liaison se produit entre deux atomes du même élément ou d'éléments proches l'un de l'autre dans le tableau périodique. Cette liaison se produit principalement entre les non-métaux, mais on peut aussi l'observer entre les non-métaux et les métaux.
Si les atomes ont des électronégativités similaires (la même affinité pour les électrons), des liaisons covalentes sont plus probables de se produire. Parce que les deux atomes ont la même affinité pour les électrons et qu'ils n'ont pas tendance à en donner, ils partagent des électrons afin d'obtenir une configuration octet et de devenir plus stables. De plus, l'énergie d'ionisation de l'atome est trop grande et l'affinité électronique de l'atome est trop faible pour que la liaison ionique se produise. Par exemple : le carbone ne forme pas de liaisons ioniques car il a 4 électrons de valence, la moitié d'un octet. Pour former des liaisons ioniques, les molécules de carbone doivent soit gagner, soit perdre 4 électrons. Ceci est très défavorable ; par conséquent, les molécules de carbone partagent leurs électrons de valence 4 à travers des liaisons simples, doubles et triples afin que chaque atome puisse obtenir des configurations de gaz noble. Les liaisons covalentes comprennent les interactions des orbites sigma et pi ; par conséquent, les liaisons covalentes conduisent à la formation de liaisons simples, doubles, triples et quadruples.
ExEmple: trichlorure de phosphore
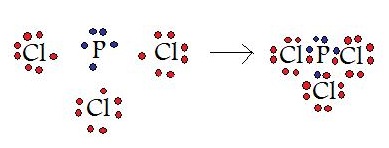
Dans cet exemple, un atome de phosphore partage ses trois électrons non appariés avec trois atomes de chlore. Dans le produit final, ces quatre molécules possèdent toutes quatre 8 électrons de valence et satisfont à la règle de l'octet.
Liaison en chimie organique
Les liaisons ioniques et covalentes sont les deux extrêmes de la liaison. La covalence polaire est le type intermédiaire de liaison entre les deux extrêmes. Certaines liaisons ioniques contiennent des caractéristiques covalentes et certaines liaisons covalentes sont partiellement ioniques. Par exemple, la plupart des composés à base de carbone sont liés par covalence mais peuvent aussi être partiellement ioniques. La polarité est une mesure de la séparation des charges dans un composé. La polarité d'un composé dépend de la symétrie du composé et des différences d'électronégativité entre les atomes. La polarité se produit lorsque les éléments poussant les électrons, qui se trouvent sur le côté gauche du tableau périodique, échangent des électrons avec les éléments attirant les électrons, sur le côté droit du tableau. Cela crée un spectre de polarité : ionique (polaire) à une extrémité, covalent (non polaire) à l'autre, et covalent polaire au milieu.
Ces deux liaisons sont importantes en chimie organique. Les liaisons ioniques sont importantes car elles permettent la synthèse de composés organiques spécifiques. Les scientifiques peuvent manipuler les propriétés ioniques et ces interactions afin de former les produits désirés. Les liaisons covalentes sont particulièrement importantes puisque la plupart des molécules de carbone interagissent principalement par liaison covalente. La liaison covalente permet aux molécules de partager des électrons avec d'autres molécules, créant de longues chaînes de composés et rendant la vie plus complexe.
Références
- Vollhardt, K. Peter C., and Neil E. Schore. Organic Chemistry Structure and Function. New York: W. H. Freeman, 2007.
- Petrucci, Ralph H. General Chemistry: Principles and Modern Applications. Upper Saddle River, NJ: Pearson Education, 2007.
- Brown, Theodore L., Eugene H. Lemay, and Bruce E. Bursten. Chemistry: The Central Science. 6th ed. Englewood Cliffs, NJ: Prentice Hall, 1994.
Problèmes de pratique
1. Ces composés sont-ils ioniques ou covalents ?
2. Dans les réactions suivantes, indiquer si les réactifs et les produits sont ioniques ou liés par covalence.
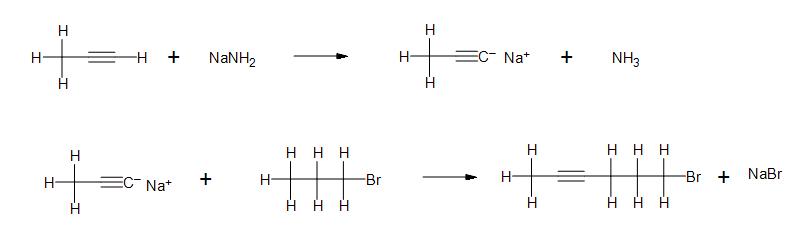
a)
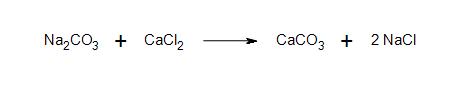
b) Clarification : Quelle est la nature du lien entre le sodium et l'amide ? Quel type de liaison se forme entre la chaîne carbonée anionique et le sodium ?
c)
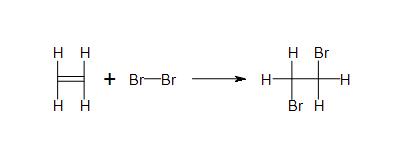
Les solutions
- 1) De gauche à droite : Covalent, Ionique, Ionique, Covalent, Covalent, Covalent, Covalent.
2a) Tous les produits et réactifs sont ioniques.
2b) liaison ionique et liaison ionique
2c) Tous les produits et réactifs sont covalents.


.jpg?revision=2)