Test de Llamas para Identificación de Metales.
- Page ID
- 168103
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)INTRODUCCIÓN
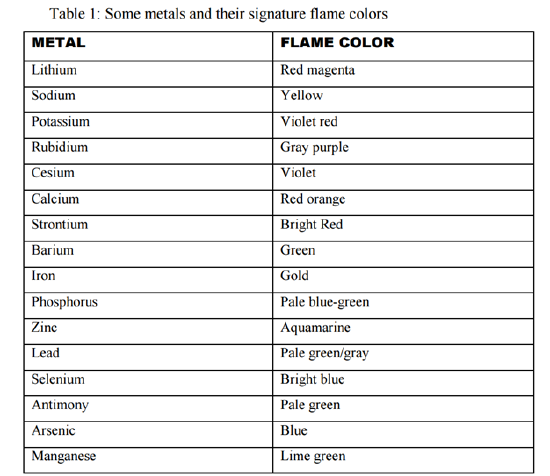
En este experimento, usted pondrá en práctica diferentes técnicas cualitativas para identificar metales alcalinos, alcalinotéreos y de transición. Table 1 de su manual de laboratorio ha sido incorporada para su conveniencia. Antes de continuar leyendo, asegúrese de haber leído las notas sobre el procedimiento para garantizar el correcto conocimiento del análisis cualitativo a hacer.
NOTAS SOBRE EL PROCEDIMIENTO
- Sodio/Sodium (Na+(aq)) es un contaminante común dentro de varias soluciones. Por lo tanto, haciendo experimentos con soluciones líquidas, una emission amarillenta de sodio es observada facilmente, inclusive cuando no había presencia de Na+(aq) en el compuesto o mezcla original.
- El vidrio de Cobalto/Cobalt (Co(s)) es un vidrio color azul, comúnmente utilizado para enmascarar emisiones amarillentas (como aquellas de sodio). Este vidrio puede ser utilizado para identificar elementos que emiten escasamente un color azul y/o violeta.
- Los líquidos o sólidos pueden ser examinados simplemente mediante la introducción del analito directamente sobre la llama. El instrumento utilizado para portar el analito (sólido o líquido) sobre la llama no debe propagar una emisión de color sobre la llama propia. Por lo tanto, en este experimento, las varas metálicas de nicromo/nichrome serán utilizadas.
PROCEDIMIENTO:
Paso 1

Para cada uno de los cationes que serán examinados, habrá que tener dos test tubes separados. Uno de los test tubes contendrá agua y la vara de nicromo; el otro test tube contendrá la solución del catión. Para evitar contaminación de los diferentes analitos, es esencial usar la vara de nicromo apropiada, es decir, solo utilizar una vara de nicromo para un tipo de solución catiónica.
Paso 2

Coloque un poco del polvo de LiCl(s) sobre una varilla de nicromo. Luego, coloque la varilla y el cristal sobre la llama, justo sobre el centro azul oscuro de la llama. El color de la llama cambiará, debido a la emisión de los iones de Li+ . Observe el color de la llama y anótelo en su cuaderno de laboratorio.
Paso 3

Esta vez, utilizando la solución de NaCl(aq), moje la varilla de nicromo en la solución catiónica. Luego, coloque la varilla directo sobre la llama, justo sobre el centro azul oscuro de la llama. Asegúrese de anotar sus observaciones en su cuaderno de laboratorio; sea considerablemente descriptivo.
Paso 4

Con la solución de KCl(aq), moje la varilla de nicromo sobre la solución catiónica. Luego, coloque la varilla directo sobre la llama, justo sobre el centro azul oscuro de la llama. Asegúrese de anotar sus observaciones en su cuaderno de laboratorio; sea considerablemente descriptivo. Es clave saber que el ión de K+(aq) es difícil de observar, por lo tanto quizás será necesario utilizar el vidrio de cobalto/cobalt (Co(s)).
Paso 5

Utilizando la solución de CuSO4(aq), moje la varilla de nicromo sobre la solución catiónica. Luego, coloque la varilla directo sobre la llama, justo sobre el centro azul oscuro de la llama. Asegúrese de anotar sus observaciones en su cuaderno de laboratorio; sea considerablemente descriptivo.
Paso 6
2(aq)_ft.png?revision=1&size=bestfit&width=312&height=312)
Utilizando la solución de Sr(NO3)2(aq), moje la varilla de nicromo en la solución catiónica. Luego, coloque la varilla directo sobre la llama, justo sobre el centro azul oscuro de la llama. Asegúrese de anotar sus observaciones en su cuaderno de laboratorio; sea considerablemente descriptivo.
Paso 7
Cristales de Composición Desconocida: Repita los pasos del experimento con la llama, esta vez utilizando uno de sus cristales pequeños del experimento anterior como su analito. Utilice una varilla de nicromo limpia y sin contaminación, del beaker que le será proporcionado por el instructor. Anote sus observaciones en su cuaderno de laboratorio; habrá que utilizar los resultados de los exámenes anteriores para determinar qué iónes metálicos (si hay alguno) están presentes en sus cristales desconocidos.


