4.2: Règle de Hückel
- Page ID
- 126935
En 1931, le chimiste et physicien allemand Erich Hückel a proposé une théorie pour aider à déterminer si une molécule à cycle plan aurait des propriétés aromatiques. Sa règle stipule que si une molécule cyclique plane possède 4n+2 électrons π, elle est considérée comme aromatique. Cette règle sera connue sous le nom de Règle de Hückel.
Quatre critères d'aromaticité
Lorsque vous décidez si un composé est aromatique, passez par la liste de contrôle suivante. Si le composé ne répond pas à tous les critères suivants, il n'est probablement pas aromatique.
- La molécule est cyclique (un anneau d'atomes)
- La molécule est plane (tous les atomes de la molécule se trouvent dans le même plan).
- La molécule est entièrement conjuguée (p orbites à chaque atome du cycle)
- La molécule a 4n+2 π électrons (n=0 ou tout entier positif)
Pourquoi 4n+2 π Électrons ?
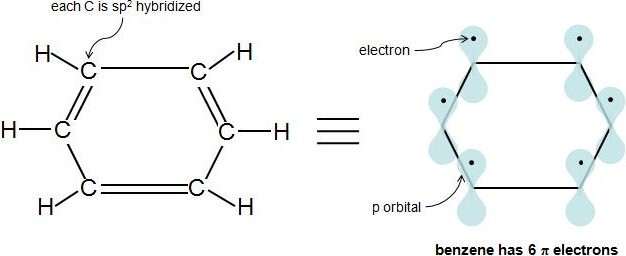
Selon la théorie orbitale moléculaire de Hückel, un composé est particulièrement stable si toutes ses orbites moléculaires de liaison sont remplies d'électrons appariés. C'est le cas des composés aromatiques, c'est-à-dire qu'ils sont assez stables. Avec les composés aromatiques, 2 électrons remplissent l'orbite moléculaire de la plus basse énergie, et 4 électrons remplissent chaque niveau d'énergie suivant (le nombre de niveaux d'énergie suivants est indiqué par n), laissant toutes les orbites de liaison remplies et aucune orbite antiliaison occupée. Cela donne un total de 4n+2 électrons. Vous pouvez voir comment cela fonctionne avec le diagramme orbital moléculaire du composé aromatique, le benzène, ci-dessous. Le benzène a 6 électrons. Ses 2 premiers électrons remplissent l'orbite d'énergie la plus basse, et il lui reste 4 électrons. Ces 4 remplissent les orbites du niveau d'énergie suivant. Remarquez comment toutes ses orbites de liaison sont remplies, mais aucune des orbites antiliaison n'a d'électrons.
.jpg?revision=1&size=bestfit&width=317&height=292)
Pour appliquer la règle 4n+2, compter d'abord le nombre d'électrons π dans la molécule. Ensuite, fixez ce nombre à 4n+2 et résolvez pour n. Si est 0 ou n'importe quel entier positif (1, 2, 3,...), la règle a été remplie. Par exemple, le benzène a six électrons :
\[\begin{align} 4n + 2 &= 6 \\ 4n &= 4 \\ n &= 1 \end{align}\]
Pour le benzène, nous trouvons que \(n=1\), qui est un entier positif, donc la règle est respectée.
Comment savoir quels électrons sont les électrons π Électrons ?
Peut-être la partie la plus difficile de la règle de Hückel est de déterminer quels électrons dans le composé sont en fait π électrons. Une fois que cela est compris, la règle est assez simple. \Les électrons se trouvent dans des orbites p et les atomes hybrides ont une orbite de 1 p chacun. Ainsi, si chaque molécule du composé cyclique est hybridée sp2, cela signifie que la molécule est entièrement conjuguée (a une orbite de 1 p à chaque atome), et les électrons dans ces p orbites sont les électrons π. Une façon simple de savoir si un atome est hybridé sp2 est de voir s'il a 3 atomes attachés et aucune paire d'électrons. Cette vidéo fournit un très beau tutoriel sur la façon de déterminer l'hybridation d'un atome. Dans un composé hydrocarboné cyclique à liaisons simples et doubles alternées, chaque carbone est lié à 1 hydrogène et 2 autres carbones. Par conséquent, chaque carbone est hybridé sp2 et a une orbite p. Examinons notre exemple précédent, le benzène :
Chaque liaison double (π bond) apporte toujours 2 électrons π. Le benzène a 3 doubles liaisons, il a donc 6 électrons π.
Ions aromatiques
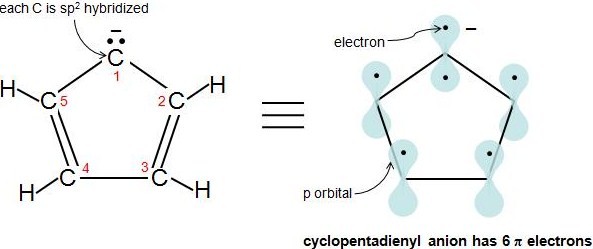
La règle de Hückel s'applique également aux ions. Tant qu'un composé possède 4n+2 électrons π, peu importe si la molécule est neutre ou a une charge. Par exemple, l'anion cyclopentadiényle est un ion aromatique. Comment savoir si elle est pleinement conjuguée ? En d'autres termes, comment savons-nous que chaque atome de cette molécule a une orbite de 1 p ? Regardons la figure suivante. Les carbones 2-5 sont hybrides sp2 parce qu'ils ont 3 atomes attachés et n'ont pas de paires d'électrons solitaires. Qu'en est-il du carbone 1 ? Une autre règle simple pour déterminer si un atome est hybridé sp2 est si un atome a 1 ou plusieurs paires solitaires et est attaché à un atome hybridé sp2, alors cet atome est également hybridé sp2. Cette vidéo explique la règle très clairement. Par conséquent, le carbone 1 a une orbite p. L'anion cyclopentadiényle possède 6 électrons π et répond à la règle 4n+2.
Composés aromatiques hétérocycliques
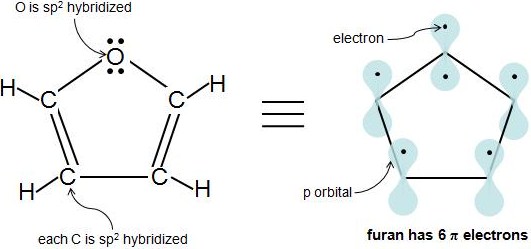
Jusqu'à présent, vous avez rencontré de nombreux cycles homocycliques de carbone, mais les composés contenant des éléments autres que le carbone dans le cycle peuvent également être aromatiques, à condition qu'ils répondent aux critères d'aromaticité. Ces molécules sont appelées composés hétérocycliques parce qu'elles contiennent un ou plusieurs atomes différents autres que le carbone dans le cycle. Un exemple courant est le furanne, qui contient un atome d'oxygène. Nous savons que tous les carbones du furane sont hybrides sp2. Mais l'atome d'oxygène sp2 est-il hybridé ? L'oxygène a au moins une paire d'électrons solitaire et est attaché à un atome hybridé sp2, donc il est également hybridé sp2. Remarquez comment l'oxygène a 2 paires d'électrons solitaires. Combien de ces électrons sont des électrons π ? Un atome hybridé sp2 n'a qu'une seule orbite de 1 p, qui ne peut contenir que 2 électrons, donc nous savons qu'une paire d'électrons est dans l'orbite p, tandis que l'autre paire est dans une orbite sp2. Ainsi, seulement 1 des 2 paires d'électrons solitaires de l'oxygène est π électrons. Furan a 6 électrons π et remplit la règle 4n+2.
UNE IDÉE FAUSSE COURANTE
Une idée fausse très répandue est que l'hybridation peut être utilisée pour prédire la géométrie, ou que l'hybridation implique en quelque sorte un coût énergétique associé à la " promotion " des électrons dans les orbites hybrides. C'est tout à fait faux. L'hybridation est toujours déterminée par la géométrie. Vous ne pouvez assigner des états d'hybridation à un atome que si vous connaissez déjà sa géométrie, basée sur des preuves expérimentales ou théoriques. La géométrie de l'oxygène dans le furanne est planaire trigonale et donc l'hybridation doit être \(sp^2\).
La règle spécifique est que si vous avez un système conjugué \(sp^2\), la paire seule sera impliquée si elle rend le système plus stable. Dans ce cas, conférer de l'aromaticité à Hückel \(4n+2\). Pour le furanne avec deux paires isolées sur l'atome d'oxygène, si nous comptons les électrons des atomes de carbone, nous en avons 4 (un par carbone). Donc, ajouter deux électrons d'une des paires solitaires donnera 6 = 4(1)+2, donc la règle de Hückel est applicable et le furanne est aromatique.


.jpg?revision=1)
.jpg?revision=1)
.jpg?revision=1)