4.3: Addition aux benzènes : catalyseurs nécessaires!
- Page ID
- 126938
L'halogénation est un exemple de substitution aromatique électrophilitique. Dans les substitutions aromatiques électrophiles, un benzène est attaqué par un électrophile, ce qui entraîne une répartition des hydrogènes. Cependant, les halogènes ne sont pas assez électrophiles pour briser l'aromaticité des benzènes, qui nécessitent un catalyseur pour s'activer.
Activation de l'halogène
(où X= Br ou Cl, nous verrons plus en détail plus loin pourquoi d'autres membres de la famille des halogènes fluorine et iode ne sont pas utilisés pour l'halogénation des benzènes)
.jpg?revision=1&size=bestfit&width=272&height=170)
Par conséquent, l'halogène a besoin de l'aide et de l'aide des catalyseurs acides de Lewis pour l'activer et devenir un électrophile très fort. Des exemples de ces halogènes activés sont les halogénures ferriques (FeX3), les halogénures d'aluminium (AlX3) où X= Br ou Cl. Dans les exemples suivants, l'halogène que nous allons regarder est le brome.
Dans l'exemple du brome, afin de rendre le brome suffisamment électrophilique pour réagir avec le benzène, nous utilisons un halogénure d'aluminium tel que le bromure d'aluminium.
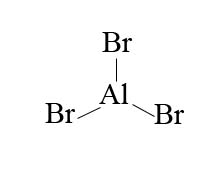
Avec le bromure d'aluminium comme acide de Lewis, on peut mélanger Br2 avec AlBr3 pour obtenir Br+. La présence de Br+ est un bien meilleur électrophile que Br2 seul. La bromation est obtenue à l'aide d'AlBr3 (catalyseurs acides de Lewis) car elle polarise la liaison Br-Br. La polarisation provoque une polarisation qui rend les atomes de brome dans la liaison Br-Br plus électrophiles. La présence de Br+ par rapport à Br2 seul est une bien meilleure électrophilie qui peut alors réagir avec le benzène.
.jpg?revision=1&size=bestfit&width=639&height=214)
Comme le brome est devenu plus électrophilique après l'activation d'un catalyseur, une attaque électrophilique par le benzène se produit au brome terminal de Br-Br-AlBr3. Ceci permet à l'autre atome de brome de partir avec l'AlBr3 comme un bon groupe partant, AlBr4-.
.jpg?revision=1&size=bestfit&width=406&height=203)
.jpg?revision=1&size=bestfit&width=482&height=283)
Après l'attaque électrophilique du bromure au benzène, l'hydrogène sur le même carbone que le brome remplace la carbocation dans laquelle résulte de l'attaque. Il s'agit donc d'une SUBSTITUTION aromatique électrophile. Comme le tétrabromure d'aluminium, sous-produit du tétrabromure d'aluminium, est un nucléophile puissant, il tire un proton de l'hydrogène sur le même carbone que le brome.
.jpg?revision=1&size=bestfit&width=481&height=224)
Au final, AlBr3 n'a pas été consommé par la réaction et est régénéré. Il sert de catalyseur dans l'halogénation des benzènes.
Les énergies de dissociation des halogènes et leurs effets sur l'halogénation des benzènes
La bromation électrophilique des benzènes est une réaction exothermique. Si l'on considère que les taux exothermiques d'halogénation aromatique diminuent dans le tableau périodique de la famille des halogènes, la floraison est la plus exothermique et l'iodation serait la moins importante. Étant si exothermique, une réaction de la farine avec le benzène est explosive ! Pour l'iode, l'iodation électrophilique est généralement endothermique, d'où une réaction souvent impossible. Comme pour le bromure, la chloration nécessiterait l'aide d'une présence activante telle que le chlorure d'aluminium ou le chlorure ferrique. Le mécanisme de cette réaction est le même que pour la bromation du benzène.

