4.1: Structure et énergie de résonance du benzène
- Page ID
- 126931
Parmi les nombreuses caractéristiques distinctives du benzène, c'est son aromaticité qui explique en grande partie pourquoi il est si peu réactif. Cette section tentera de clarifier la théorie de l'aromaticité et pourquoi l'aromaticité donne des qualités uniques qui rendent ces alcènes conjugués inertes aux composés comme le Br2 et même l'acide chlorhydrique. Il traitera également en détail de l'énergie de résonance inhabituellement importante due aux six carbones conjugués du benzène.
La délocalisation des carbones p-orbitaux sur les carbones hybrides sp2 est ce qui donne les qualités aromatiques du benzène.
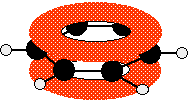
Ce diagramme montre l'une des orbitales moléculaires contenant deux des électrons délocalisés, que l'on peut trouver n'importe où dans les deux "donuts". Les autres orbitales moléculaires ne sont presque jamais dessinées.
- benzène (\(C_6H_6\)) est une molécule plane contenant un cycle de six atomes de carbone, chacun avec un atome d'hydrogène attaché.
- Les six atomes de carbone forment un hexagone parfaitement régulier. Toutes les liaisons carbone-carbone ont exactement la même longueur, entre simple et double liaison.
- Il y a des électrons délocalisés au-dessus et au-dessous du plan de l'anneau, ce qui rend le benzène particulièrement stable.
- Le benzène résiste aux réactions d'addition parce que ces réactions entraîneraient la rupture de la délocalisation et la perte de cette stabilité.
En raison de l'aromaticité du benzène, la molécule résultante a une forme plane, chaque liaison C-C ayant une longueur de 1,39 Å et un angle de liaison de 120°. Vous pourriez vous demander comment il est possible d'avoir toutes les liaisons d'avoir la même longueur si l'anneau est conjugué à la fois simple (1,47 Å) et double (1,34 Å), mais il est important de noter qu'il n'y a aucune liaison simple ou double distincte dans le benzène. Au contraire, la délocalisation de l'anneau fait en sorte que chaque liaison compte pour une liaison et demie entre les atomes de carbone, ce qui est logique car, expérimentalement, nous constatons que la longueur réelle de la liaison se situe entre une simple et une double liaison. Enfin, il y a un total de six électrons p-orbitaux qui forment les nuages d'électrons stabilisateurs au-dessus et au-dessous du noyau aromatique.
.bmp?revision=1)
Si le benzène est forcé de réagir en augmentant la température et/ou en ajoutant un catalyseur, il subit des réactions de substitution plutôt que les réactions d'addition qui sont typiques des alcènes. Cela confirme une fois de plus l'indication précédente selon laquelle le noyau benzénique à six atomes de carbone est exceptionnellement stable aux modifications chimiques. La contradiction conceptuelle présentée par un degré élevé d'insaturation (faible rapport H:C) et une stabilité chimique élevée pour le benzène et les composés apparentés est restée un casse-tête non résolu pendant plusieurs années. Finalement, la structure actuellement acceptée d'un anneau régulier hexagonal planaire de carbone a été adoptée, et la stabilité thermodynamique et chimique exceptionnelle de ce système a été attribuée à la stabilisation par résonance d'un triène cyclique conjugué.
La grande stabilité du benzène
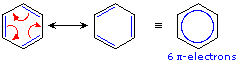
Ici, deux structures électroniques structurellement et énergétiquement équivalentes pour un composé stable sont écrites, mais aucune structure unique ne fournit une représentation précise ou même adéquate de la molécule vraie. L'anneau à six chaînons en benzène est un hexagone parfait (toutes les liaisons carbone-carbone ont une longueur identique de 1,40 Å). On s'attendrait à ce que les contributeurs de cyclohexatriène présentent des longueurs de liaison alternées, les doubles liaisons étant plus courtes (1,34 Å) que les simples liaisons (1,54 Å). Une représentation alternative du benzène (cercle à l'intérieur d'un hexagone) met l'accent sur la délocalisation du pi-électron dans cette molécule, et a l'avantage d'être un diagramme unique. Dans de tels cas, la délocalisation d'électrons décrite par résonance améliore la stabilité des molécules, et les composés composés composés de ces molécules présentent souvent une stabilité exceptionnelle et des propriétés connexes.
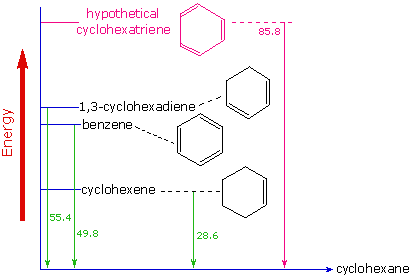
La stabilité thermodynamique améliorée du benzène a été démontrée par des mesures de la chaleur dégagée lors de l'hydrogénation de doubles liaisons dans un cycle à six atomes de carbone (l'hydrogène est ajouté catalytiquement) pour obtenir du cyclohexane comme produit commun. Dans le diagramme suivant, le cyclohexane représente un point de référence basse énergie. L'addition d'hydrogène au cyclohexène produit du cyclohexane et dégage une chaleur de 28,6 kcal par mole. Si nous prenons cette valeur pour représenter le coût énergétique de l'introduction d'une double liaison dans un cycle à six atomes de carbone, nous nous attendons à ce qu'un cyclohexadiène libère 57,2 kcal par mole après hydrogénation complète, et le 1,3,5-cyclohexatriène 85,8 kcal par mole. Ces chaleurs d'hydrogénation refléteraient la stabilité thermodynamique relative des composés. En pratique, le 1,3-cyclohexadiène est légèrement plus stable que prévu, d'environ 2 kcal, probablement en raison de la conjugaison des doubles liaisons. Le benzène, cependant, est un extraordinaire 36 kcal/mole plus stable que prévu. Ce type d'amélioration de la stabilité est maintenant accepté comme une caractéristique de tous les composés aromatiques.
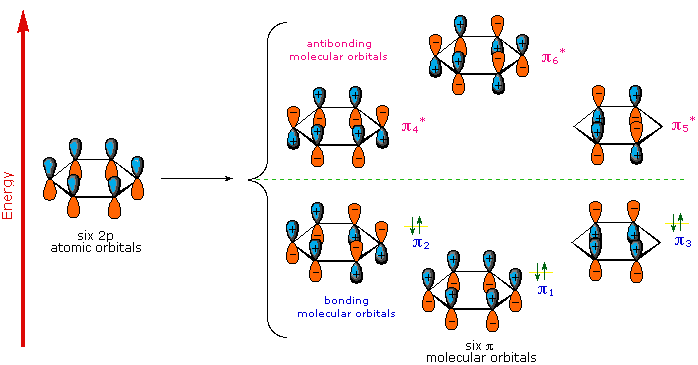
Une description moléculaire orbitale du benzène permet un traitement plus satisfaisant et plus général de l'"aromaticité". Nous savons que le benzène a une structure hexagonale plane dans laquelle tous les atomes de carbone sont hybridées sp2, et toutes les liaisons carbone-carbone sont de longueur égale. Comme on le voit ci-dessous, les six p-orbitaux cycliques restants (un sur chaque carbone) se chevauchent pour générer six orbites moléculaires, trois à liaison et trois à anticollage. Les signes plus et moins indiqués dans le diagramme ne représentent pas une charge électrostatique, mais se réfèrent aux signes de phase dans les équations qui décrivent ces orbites (dans le diagramme, les phases sont également codées en couleur). Lorsque les phases correspondent, les orbites se chevauchent pour générer une région commune de phase similaire, les orbites ayant le plus grand chevauchement (p. ex. π1) étant les plus faibles en énergie. Les électrons de valence carbone restants occupent alors ces orbitales moléculaires par paires, ce qui donne un ensemble d'orbitales moléculaires de liaison entièrement occupé (6 électrons). C'est cet ensemble complètement rempli d'orbites de liaison, ou coque fermée, qui confère à l'anneau benzénique sa stabilité thermodynamique et chimique, tout comme un octuor de valence rempli confère la stabilité aux gaz inertes.
Les orbitales moléculaires du benzène