2.2: Rotation autour d'une simple liaison et conformations résultantes
- Page ID
- 126834
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)
L'isomérisme conformationnel implique une rotation autour des liaisons sigma, et n'implique aucune différence dans la connectivité ou la géométrie de la liaison. Deux structures ou plus qui sont classées comme isomères conformationnels, ou conformateurs, ne sont en fait que deux des mêmes molécules qui ne diffèrent que par l'angle d'une ou plusieurs liaisons sigma.
Conformations d'éthane
Bien qu'il y ait sept liaisons sigma dans la molécule d'éthane, la rotation autour des six liaisons carbone-hydrogène n'entraîne aucun changement dans la forme de la molécule car les atomes d'hydrogène sont essentiellement sphériques. La rotation autour de la liaison carbone-carbone entraîne cependant de nombreuses conformations moléculaires différentes possibles.
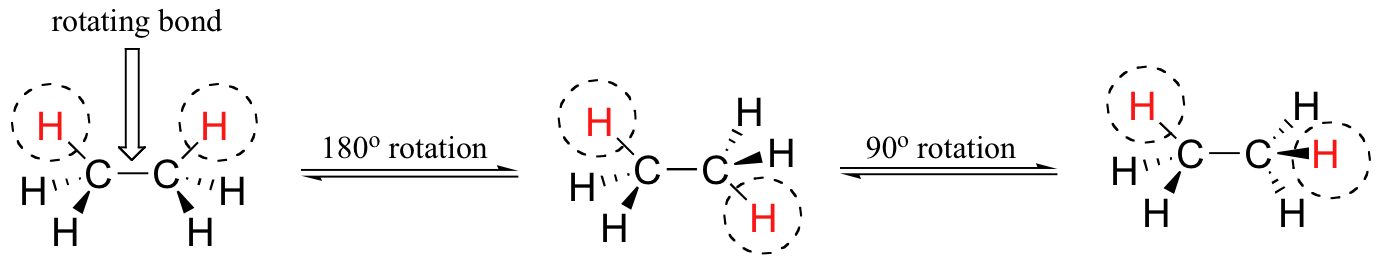
Afin de mieux visualiser ces différentes conformations, il est pratique d'utiliser une convention de dessin appelée projection Newman. Dans une projection de Newman, nous regardons dans le sens de la longueur un lien d'intérêt spécifique - dans ce cas, le lien carbone-carbone dans l'éthane. Nous dépeignons l'atome " avant " comme un point, et l'atome " arrière " comme un cercle plus grand.

Les six liaisons carbone-hydrogène sont représentées sous forme de lignes pleines dépassant des deux carbones à des angles de 120°, ce à quoi ressemble la géométrie tétraédrique telle qu'elle est vue sous cet angle et aplatie en deux dimensions.
La plus faible conformation énergétique de l'éthane, montrée dans la figure ci-dessus, est appelée la conformation " décalée " (anglais: staggered), dans laquelle toutes les liaisons C-H sur le carbone avant sont positionnées à des angles dièdres de 60° par rapport aux liaisons C-H sur le carbone arrière. Dans cette conformation, la distance entre les liaisons (et les électrons qu'elles contiennent) est maximisée.
Si l'on fait maintenant tourner le groupe CH3 avant de 60° dans le sens des aiguilles d'une montre, la molécule est dans la conformation " éclipsée " (anglais: eclipsed) la plus énergétique, où les hydrogènes sur le carbone avant sont aussi proches que possible des hydrogènes sur le carbone arrière.
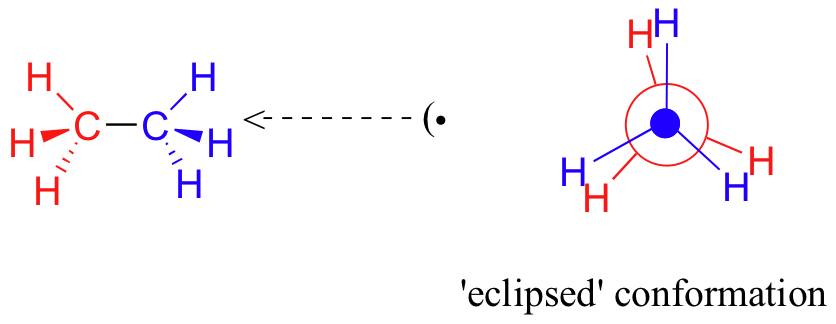
C'est la conformation énergétique la plus élevée en raison des interactions défavorables entre les électrons dans les liaisons C-H avant et arrière. L'énergie de la conformation éclipsée est d'environ 3 kcal/mol supérieure à celle de la conformation décalée. Une autre rotation de 60° ramène la molécule à une seconde conformation éclipsée. Ce processus peut se poursuivre tout autour du cercle de 360°, avec trois conformations éclipsées possibles et trois conformations décalées, en plus d'un nombre infini de variations entre elles.
Les rotations libres n'existent pas dans l'éthane
Le lien carbone-carbone n'est pas complètement libre de tourner - il y a en effet une petite barrière de 3 kcal/mol à la rotation qui doit être surmontée pour que le lien tourne d'une conformation décalée à une autre. Cette barrière de rotation n'est pas assez haute pour empêcher une rotation constante, sauf à des températures extrêmement froides. Cependant, à un moment donné, la molécule est plus susceptible d'être dans une conformation décalée - l'une des " vallées énergétiques " de rotation - que dans tout autre état. L'énergie potentielle associée aux différentes conformations de l'éthane varie en fonction de l'angle dihédrale des liaisons, comme indiqué ci-dessous.
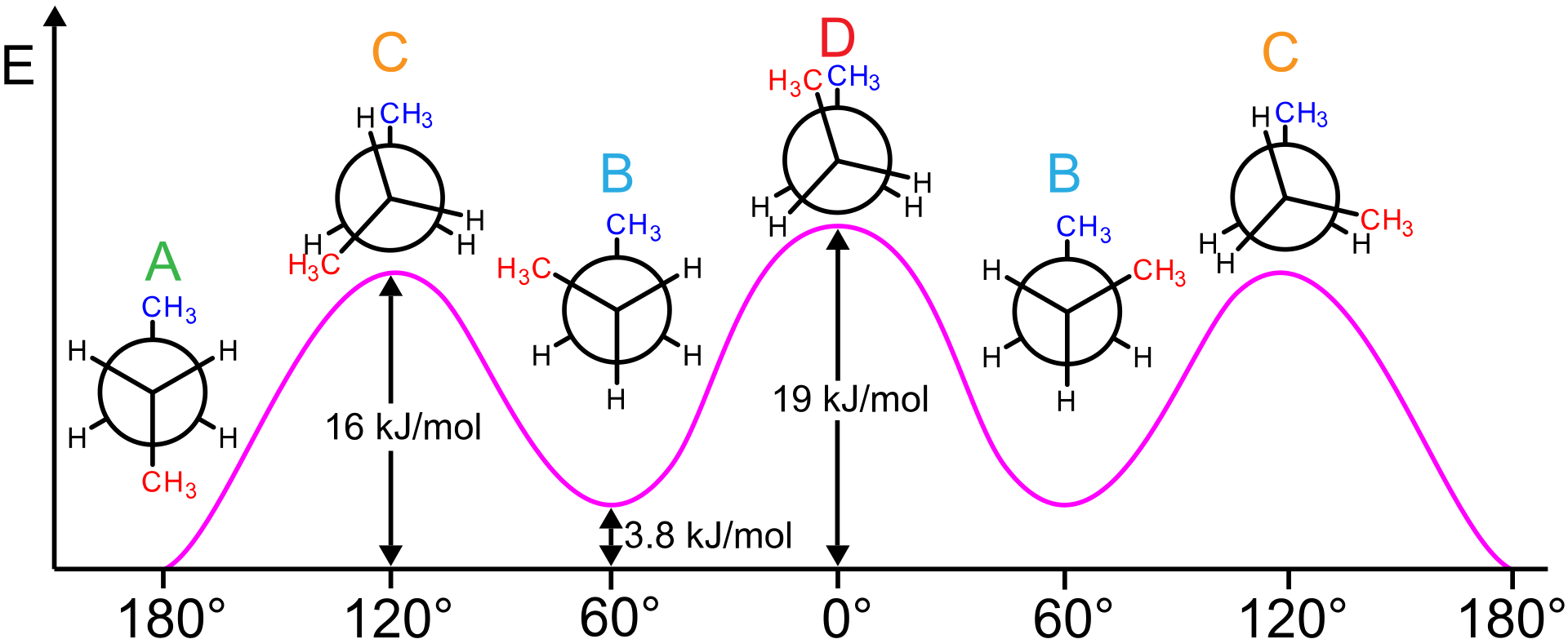
Figure 3.6.6.X : L'énergie potentielle associée aux différentes conformations de l'éthane varie selon l'angle dihédrale des liaisons. Projections Newman des conformations au butane et de leurs différences d'énergie relatives (et non des énergies totales). Des conformations se forment lorsque le butane tourne autour d'une de ses liaisons covalentes simples. L'angle de torsion/diédrique est indiqué sur l'axe des abscisses. Conformations (selon l'UICPA) : A : antiperiplanaire, anti ou trans B : synclinal ou gauche C : anticlinal ou éclipsé D : synperiplanaire ou cis Les vallées du graphique rose sont les conformations les moins énergétiques (représentées par A & B). Les pics sont les conformations les plus élevées en énergie (indiquées en C et D). Les énergies sont A<B<C<D avec D le plus haut et A le plus bas en énergie. A est donc la conformation la plus stable &, de toutes les autres conformations, elle se produit le plus souvent à température ambiante. Les vallées A et B sont des minima énergétiques locaux et A est des minima globaux. A et B peuvent donc être classés comme des rotamères (une classe de conformateurs). Les pics ne sont pas des rotamères, et sont causés par les forces répulsives des hydrogènes et des méthyls (-CH3). Source pour les noms de conformation et la classification des conformation : Pure & Appl. chimie pure, vol. 68, n° 12, pp. 2193-2222, 1996 Image utilisée avec permission (domaine public ; Keministi).
Bien que les conformateurs de l'éthane soient en équilibre rapide les uns avec les autres, la différence d'énergie de 3 kcal/mol conduit à une prépondérance substantielle de conformateurs décalés (> 99,9%) à un moment donné. L'animation ci-dessous illustre la relation entre l'énergie potentielle de l'éthane et son angle dihédrale
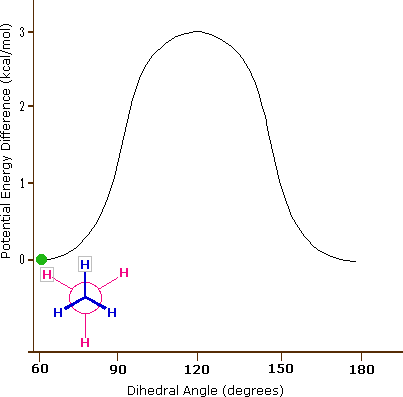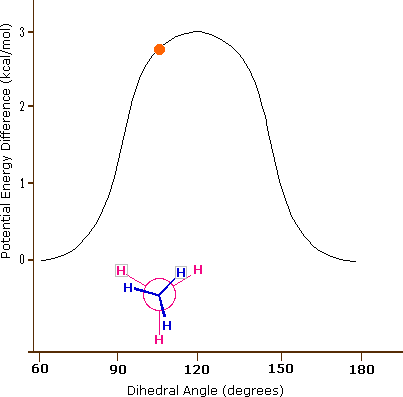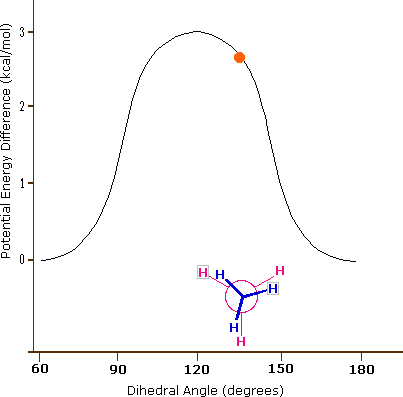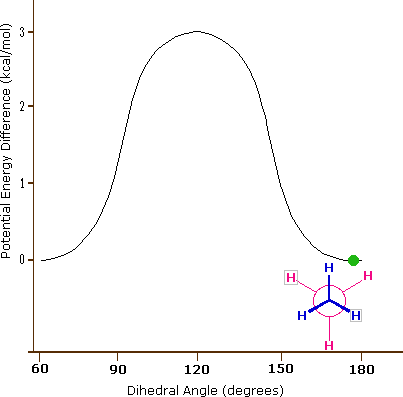
Figure 3.6.6.X : Animation de l'énergie potentielle par rapport à l'angle dihédrale dans l'éthane

