2.3: Rotation dans des éthanes substitués
- Page ID
- 126835
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)
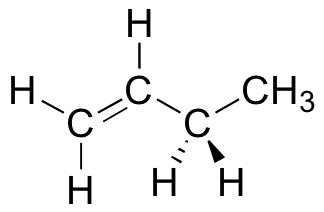
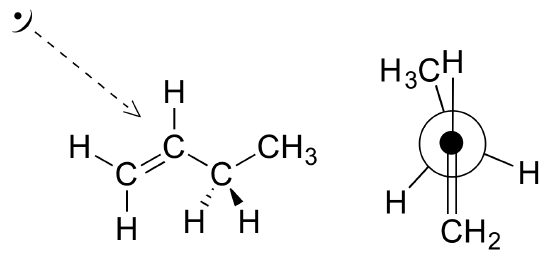
Dans le butane, il y a maintenant trois liaisons carbone-carbone tournantes à considérer, mais nous nous concentrerons sur la liaison intermédiaire entre C2 et C3. Voici deux représentations du butane dans une conformation qui place les deux groupes CH3 (C1 et C4) en position éclipsée.
C'est la conformation énergétique la plus élevée pour le butane, en raison de ce qu'on appelle la " répulsion van der Waals ", ou " répulsion stérique ", entre les deux groupes méthyle plutôt volumineux.
Qu'est-ce que la répulsion van der Waals ? Considérez ceci : vous aimez probablement être près de vos amis, mais peu importe à quel point vous êtes proche, vous ne voulez probablement pas partager un appartement d'une pièce avec cinq d'entre eux. Lorsque les deux groupes méthyles sont rapprochés trop près l'un de l'autre, l'interaction globale non covalente qui en résulte est répugnante plutôt qu'attrayante. Il en résulte que leurs densités d'électrons respectives se repoussent les unes les autres.
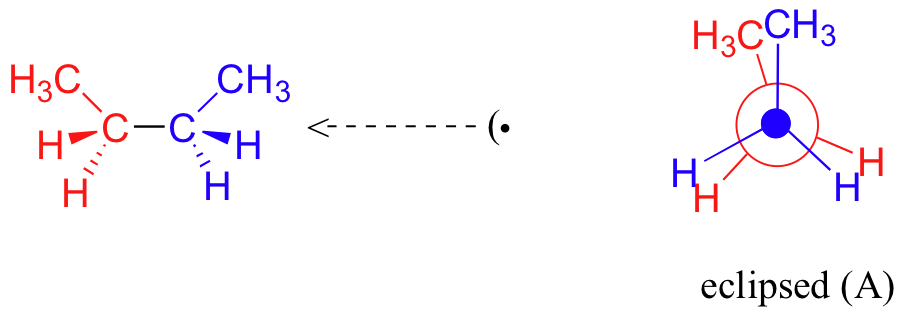
Si l'on fait tourner le carbone avant (bleu) de 60° dans le sens des aiguilles d'une montre, la molécule de butane est maintenant dans une conformation décalée.
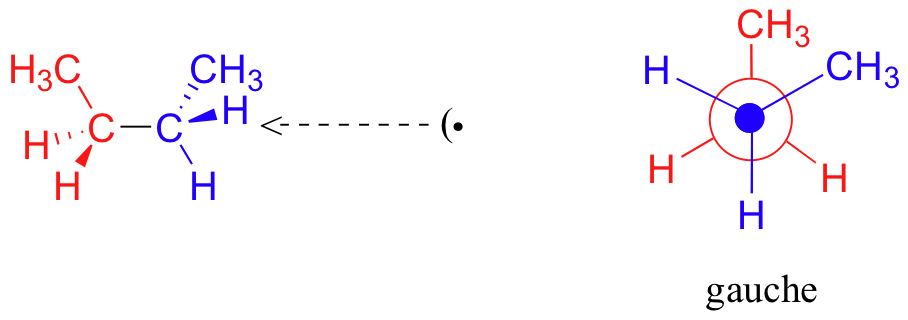
C'est ce qu'on appelle plus précisément la conformation " gauche " du butane. Notez que bien qu'ils soient décalés, les deux groupes méthyle ne sont pas aussi éloignés qu'ils pourraient l'être. Il y a encore une répulsion stérique importante entre les deux groupes encombrants. Une rotation supplémentaire de 60° nous donne une seconde conformation éclipsée (B) dans laquelle les deux groupes méthyle sont alignés avec des atomes d'hydrogène.
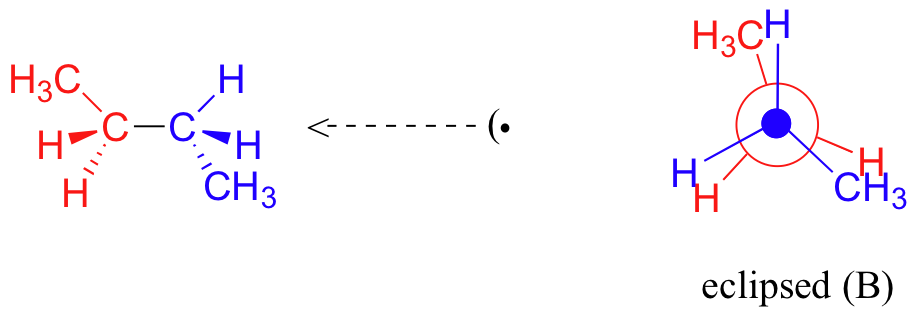
En raison de la répulsion stérique entre les substituants méthyle et hydrogène, cette conformation éclipsée B est plus énergétique que la conformation gauche. Cependant, comme il n'y a pas d'éclipse de méthyle à méthyle, son énergie est inférieure à celle de la conformation éclipsée A. Une rotation de 60 degrés de plus produit l'anti-conformation, où les deux groupes méthyle sont positionnés l'un en face de l'autre et la répulsion stérique est réduite.
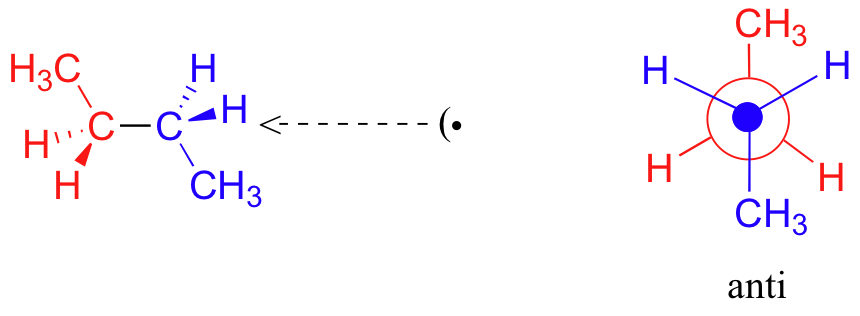
Il s'agit de la conformation énergétique la plus basse pour le butane. Le diagramme ci-dessous résume les énergies relatives des différentes conformations éclipsées, décalées et gauches.
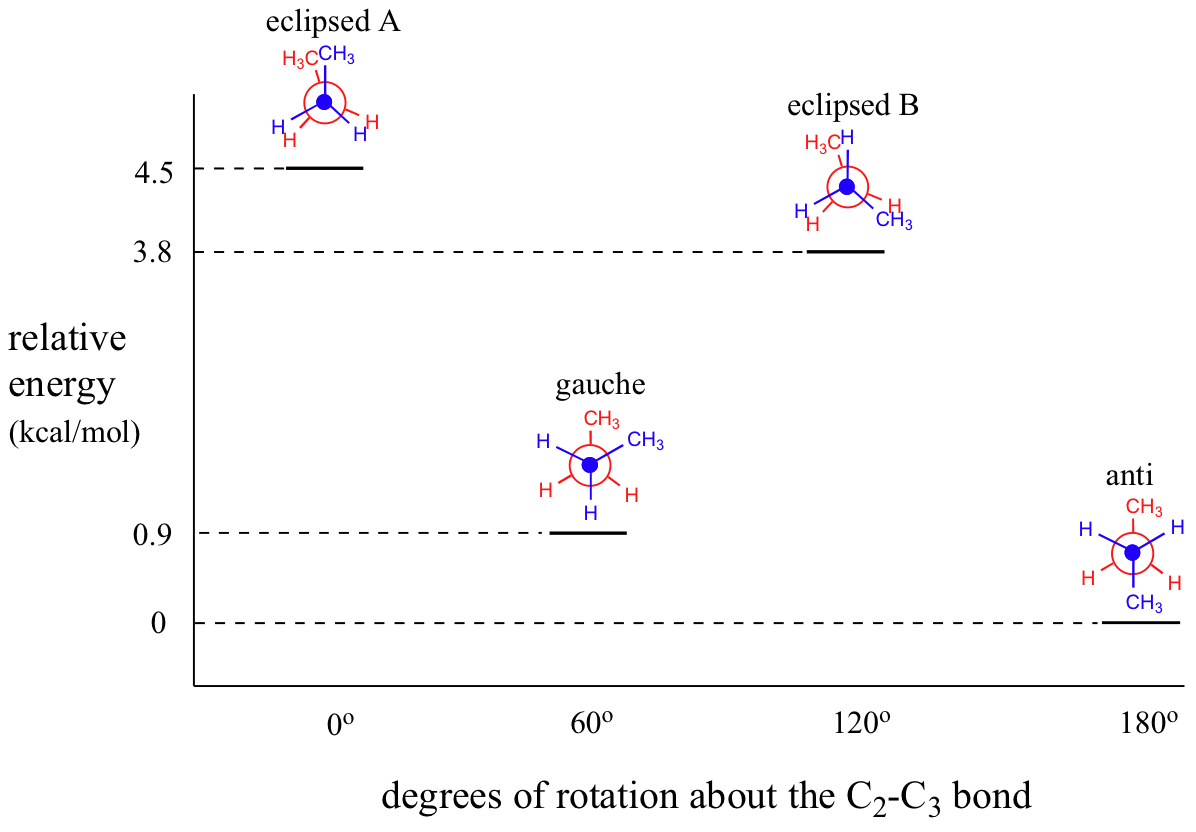
A température ambiante, le butane est le plus susceptible d'être dans la plus basse énergie anti conformation à un moment donné dans le temps, bien que la barrière énergétique entre les conformations anti et éclipsée ne soit pas assez élevée pour empêcher une rotation constante sauf à très basse température. Pour cette raison (et aussi simplement pour faciliter le dessin), il est conventionnel de dessiner les alcanes à chaîne droite en zigzag, ce qui implique une anti conformation à toutes les liaisons carbone-carbone.
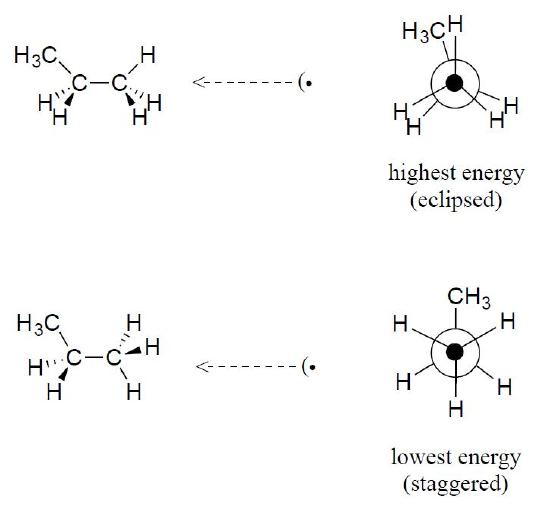
ExEMPLE
Dessinez les projections Newman des conformations éclipsées et décalées du propane.
- Answer:
Le diagramme suivant illustre le changement d'énergie potentielle qui se produit lors de la rotation autour de la liaison C2-C3.
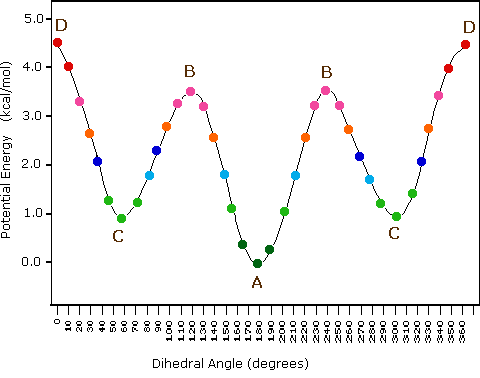
Figure 1: Courbe d'énergie potentielle en fonction de l'angle dihédrale de la liaison C2-C3 du butane.