2.1: Propriétés structurales et physiques des alcanes
- Page ID
- 126833
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Les alcanes ne sont pas très réactifs et ont peu d'activité biologique ; tous les alcanes sont incolores et inodores.
Points d'ébullition
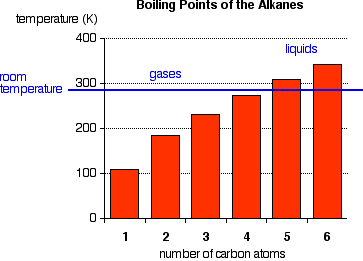
Les points d'ébullition indiqués ci-dessous concernent les isomères à "chaîne droite" dont il y en a plus d'un. Les quatre premiers alcanes sont des gaz à température ambiante, et les solides ne commencent à apparaître que vers C17H36, mais c'est imprécis car les différents isomères ont généralement différents points de fusion et d'ébullition. Le temps que vous mettiez 17 carbones dans un alcane, il y a un nombre incroyable d'isomères !
Les cycloalcanes ont des points d'ébullition supérieurs d'environ 20 K à ceux de l'alcane à chaîne droite correspondant.
Il n'y a pas de différence significative de électronégativité entre le carbone et l'hydrogène, il n'y a donc pas de polarité de liaison significative. Les molécules elles-mêmes ont également très peu de polarité. Une molécule totalement symétrique comme le méthane est complètement non polaire, ce qui signifie que les seules attractions entre une molécule et ses voisins seront les forces de dispersion de Van der Waals. Ces forces seront très faibles pour une molécule comme le méthane, mais elles augmenteront à mesure que les molécules grossissent (pensez aux membranes biologiques et aux micelles). Par conséquent, les points d'ébullition des alcanes augmentent avec la taille moléculaire.
Là où il y a des isomères, plus la chaîne est ramifiée, plus le point d'ébullition a tendance à être bas. Les forces de dispersion de Van der Waals sont plus faibles pour des molécules plus courtes et ne fonctionnent que sur de très courtes distances entre une molécule et ses voisins. Il est plus difficile pour les molécules courtes et grasses (avec beaucoup de ramifications) de se trouver aussi près les unes des autres que les molécules longues et minces.
| Exemple |
|---|
|
Par exemple, les points d'ébullition des trois isomères de C5H12 sont :
Les points d'ébullition légèrement plus élevés des cycloalcanes sont probablement dus au fait que les molécules peuvent se rapprocher les unes des autres parce que la structure cyclique les rend plus ordonnées et moins "frétillantes" ! |
Solubilité
Les alcanes (alcanes et cycloalcanes) sont pratiquement insolubles dans l'eau, mais se dissolvent dans les solvants organiques. Cependant, les alcanes liquides sont de bons solvants pour de nombreux autres composés organiques non ioniques.
Solubilité dans l'eau
Lorsqu'une substance moléculaire se dissout dans l'eau, les conditions suivantes doivent se produire :
- briser les forces intermoléculaires à l'intérieur de la substance. Dans le cas des alcanes, ce sont les forces de dispersion de Van der Waals.
- briser les forces intermoléculaires dans l'eau afin que la substance puisse s'adapter entre les molécules d'eau. Dans l'eau, les principales attractions intermoléculaires sont les liaisons hydrogène.
Briser l'une ou l'autre de ces attractions nécessite de l'énergie, bien que la quantité d'énergie nécessaire pour briser les forces de dispersion de Van der Waals dans quelque chose comme le méthane soit relativement négligeable ; ceci n'est pas le cas des liaisons hydrogène de l'eau.
Pour simplifier, une substance se dissoudra s'il y a suffisamment d'énergie libérée lorsque de nouvelles liaisons sont établies entre la substance et l'eau pour compenser ce qui est utilisé pour briser les attractions originales. Les seules nouvelles attractions entre l'alcane et les molécules d'eau sont les forces de Van der Waals. Ces forces ne libèrent pas une quantité d'énergie suffisante pour compenser l'énergie nécessaire à la rupture des liaisons hydrogène dans l'eau. L'alcane ne se dissout pas.
Note : Il s'agit d'une simplification car les effets entropiques sont importants lorsque les choses se dissolvent.
Solubilité dans les solvants organiques
Dans la plupart des solvants organiques, les principales forces d'attraction entre les molécules de solvant sont les Van der Waals - soit les forces de dispersion, soit les attractions dipôles-dipôles. Par conséquent, lorsqu'un alcane se dissout dans un solvant organique, les forces de Van der Waals sont brisées et sont remplacées par de nouvelles forces de Van der Waals. Les deux processus s'annulent plus ou moins énergétiquement ; il n'y a donc pas de barrière à la solubilité.

