2.4: La tension de cycle et la structure des cycloalcanes
- Page ID
- 126839
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)
Les cycloalcanes ont un ou plusieurs cycles d'atomes de carbone. Les exemples les plus simples de cette classe se composent d'un seul cycle de carbone non ramifié, qui forment une série homologue semblable aux alcanes non ramifiés. Les noms des cinq premiers membres de l'UICPA de cette série sont donnés dans le tableau suivant. La dernière colonne (ombrée en jaune) donne la formule générale pour un cycloalcane de toute taille. Si un simple alcane non ramifié est transformé en cycloalcane, deux atomes d'hydrogène, un à chaque extrémité de la chaîne, doivent être perdus. Par conséquent, la formule générale pour un cycloalcane composé de n carbones est CnH2n. Bien qu'un cycloalcane ait deux hydrogènes de moins que l'alcane équivalent, chaque carbone est lié à quatre autres atomes, de sorte que ces composés sont toujours considérés comme saturés d'hydrogène.
Tableau 1:Exemples de cycloalcanes simples
| Nom | Cyclopropane | Cyclobutane | Cyclopentane | Cyclohexane | Cycloheptane | Cycloalcane |
|---|---|---|---|---|---|---|
| Formule moléculaire | C3H6 | C4H8 | C5H10 | C6H12 | C7H14 | CnH2n |
| Formule structurelle | 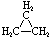 |
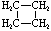 |
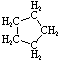 |
 |
 |
(CH2)n |
| Formule de ligne | 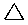 |
 |
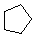 |
 |
 |
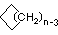 |
La théorie de Baeyer sur la tension dans les cycles de cycloalcane
Bon nombre des propriétés du cyclopropane et de ses dérivés sont semblables à celles des alcènes. En 1890, le célèbre chimiste organique allemand A. Baeyer a suggéré que les dérivés du cyclopropane et du cyclobutane sont différents du cyclopentane et du cyclohexane, car leurs angles C-C-C ne peuvent avoir la valeur tétraédrique de 109,5°. Dans le même temps, Baeyer a posé l'hypothèse que les difficultés rencontrées dans la synthèse des cycles cycloalcanes à partir de C7 vers le haut étaient le résultat de la déformation angulaire qui serait attendue si les grands cycles étaient des polygones plans réguliers (Tableau \(\PageIndex{1}\)). Baeyer croyait également que le cyclohexane avait une structure plane, ce qui signifierait que les angles de liaison devraient s'écarter de 10,5° de la valeur tétraédrique. Cependant, en 1895, le chimiste alors inconnu H. Sachse a suggéré que le cyclohexane existe sous les formes sans déformation de chaise et de bateau. Cette suggestion n'a pas été acceptée à l'époque car elle a permis de prédire plusieurs isomères possibles pour des composés comme le chlorocyclohexane. L'idée que de tels isomères puissent agir comme une seule substance, résultat d'un équilibre rapide, semblait être une complication inutile, et ce n'est qu'en 1918 que E. Mohr a proposé une façon définitive de distinguer les cyclohexanes de Baeyer et de Sachse.
| Composé | Tension angulaire à chaque CH2 |
Chaleur de combustion |
Chaleur de combustion |
Tension totale (kcal/mol) | |
|---|---|---|---|---|---|
| éthène | 2 | 109.5 | 337.2 | 168.6 | 22.4 |
| cyclopropane | 3 | 49.5 | 499.9 | 166.6 | 27.7 |
| cyclobutane | 4 | 19.5 | 655.9 | 164.0 | 26.3 |
| cyclopentane | 5 | 1.5 | 793.4 | 158.7 | 6.5 |
| cyclohexane | 6 | 10.5 | 944.8 | 157.5 | 0.4 |
| cycloheptane | 7 | 19.1 | 1108.1 | 158.4 | 6.3 |
| cyclooctane | 8 | 25.5 | 1268.9 | 158.6 | 9.7 |
| cyclononane | 9 | 30.5 | 1429.5 | 158.8 | 12.9 |
| cyclodecane | 10 | 34.5 | 1586.1 | 158.6 | 12.1 |
| cyclopentadecane | 15 | 46.5 | 2362.5 | 157.5 | 1.5 |
| alcane à chaîne ouverte | 157.4 | - |
Tension de cycle dans les cycloalcanes
La tension de cycle se produit parce que les carbones dans les cycloalcanes sont hybridées sp3, ce qui signifie qu'ils n'ont pas l'angle de liaison idéal prévu de 109,5o ; ceci entraîne une augmentation de l'énergie potentielle en raison du désir que les carbones soient à 109,5o idéal. Un exemple de tension de cycle peut être vu dans le diagramme de cyclopropane ci-dessous dans lequel l'angle de liaison est de 60o entre les carbones.
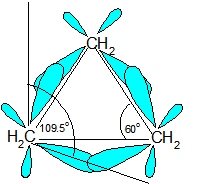
La raison de la déformation de l'anneau peut être vue à travers le modèle de carbone tétraédrique. Les angles de liaison C-C-C-C du cyclopropane (diagramme ci-dessus) (60o) et du cyclobutane (90o) sont très différents de l'angle de liaison idéal de 109,5o. Cet angle de liaison fait que le cyclopropane et le cyclobutane présentent une tension de cycle élevée. Cependant, des molécules comme le cyclohexane et le cyclopentane auraient une tension de cycle beaucoup plus faible parce que l'angle de liaison entre les carbones est beaucoup plus proche de 109,5o.
Voici quelques exemples de cycloalcanes. La tension de cycle peut être vue plus fréquemment dans les modèles de cyclopropane et de cyclobutane.
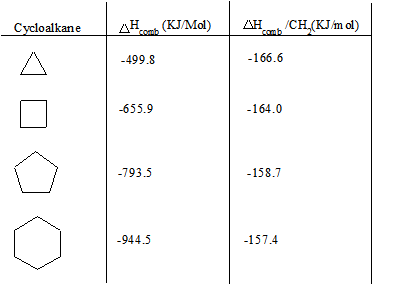
Vous trouverez ci-dessous un tableau des cycloalcanes et de leurs chaleurs de combustion respectives (ΔHcomb). La valeur de ΔHcomb augmente à mesure que le nombre de carbones dans le cycloalcane augmente (cycle à membres plus élevés), et le rapport ΔHcomb/CH2 diminue. L'augmentation de ΔHcomb peut être attribuée à la plus grande quantité de forces de dispersion de Londres. Cependant, la diminution de ΔHcomb/CH2 peut être attribuée à une diminution de la tension dans le cycle.
Structure des cycloalcanes
Bien que les dessins au trait habituels des cycloalcanes simples soient des polygones géométriques, la forme réelle de ces composés est très différente dans la plupart des cas.
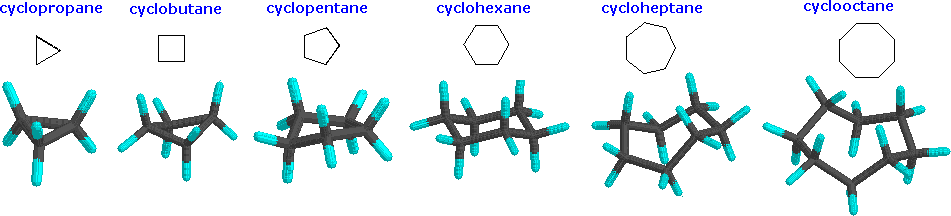
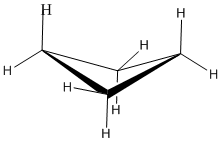
Le cyclopropane est nécessairement plan (plat), avec les atomes de carbone aux coins d'un triangle équilatéral. Les angles de liaison de 60º sont beaucoup plus petits que les angles optimaux de 109,5º d'un atome de carbone tétraédrique normal, et la tension angulaire résultante influence considérablement le comportement chimique de ce cycloalcane. Le cyclopropane subit également une importante contrainte d'éclipse, puisque toutes les liaisons carbone-carbone sont complètement éclipsées. Le cyclobutane réduit certaines contraintes d'éclipse de liaison par pliage (l'angle dièdre hors plan est d'environ 25º), mais la contrainte totale d'éclipse et d'angle reste élevée. Le cyclopentane a très peu de tension angulaire (les angles d'un pentagone sont de 108º), mais sa tension d'éclipse serait importante (environ 10 kcal/mol) s'il restait plan. Par conséquent, l'anneau à cinq chaînons adopte autant que possible des conformations non planes et plissées.
Les cycles plus grands que le cyclopentane auraient une tension angulaire s'ils étaient plans. Cependant, cette contrainte, ainsi que la contrainte d'éclipse inhérente à une structure plane, peuvent être soulagées en pliant l'anneau. Le cyclohexane est un bon exemple de système carbocyclique qui élimine virtuellement l'éclipse et la déformation angulaire en adoptant des conformations non planes. Le cycloheptane et le cyclooctane sont plus sollicités que le cyclohexane, en grande partie à cause de l'encombrement transannulaire (entrave stérique par des groupes situés sur les côtés opposés de l'anneau).
Les systèmes cycliques sont un peu différents des systèmes à chaîne ouverte. Dans une chaîne ouverte, n'importe quelle liaison peut être tournée de 360 degrés, en passant par de nombreuses conformations différentes. Cette rotation complète n'est pas possible dans un système cyclique, parce que les pièces que vous essaieriez d'éloigner l'une de l'autre seraient toujours reliées ensemble. Les systèmes cycliques ont moins de "degrés de liberté" que les systèmes aliphatiques ; ils ont une "rotation limitée".
En raison de la rotation limitée des systèmes cycliques, la plupart d'entre eux ont des formes beaucoup plus bien définies que leurs homologues aliphatiques. Jetons un coup d'oeil aux formes de base de quelques anneaux communs.
- De nombreux composés biologiquement importants sont construits autour de structures contenant des anneaux, il est donc important que nous nous familiarisions avec eux.
- Dans la nature, on rencontre fréquemment des anneaux à trois ou six membres, alors nous allons nous concentrer sur ceux-ci.
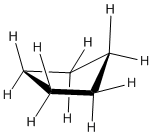
Cyclopropane
Un cycle à trois membres n'a aucune liberté de rotation. Un plan est défini par trois points, de sorte que les trois atomes de carbone dans le cyclopropane sont tous contraints de se trouver dans le même plan.
De plus, si vous regardez un modèle, vous constaterez que les liaisons C-H voisines (également les liaisons C-C) sont toutes tenues dans des conformations éclipsées.
Le cyclopropane est toujours soumis à une contrainte de torsion maximale. Cette souche peut être illustrée par un dessin au trait de cyclopropane tel qu'illustré sur le côté. Dans cette vue oblique, les lignes sombres signifient que ces côtés de l'anneau sont plus proches de vous.
Cependant, l'anneau n'est pas assez grand pour introduire une tension stérique, qui ne devient pas un facteur jusqu'à ce que nous atteignions six anneaux à six membres. Jusque-là, les anneaux ne sont pas assez flexibles pour permettre à deux atomes de s'approcher et de se heurter l'un l'autre.
Le très gros problème avec le cyclopropane est que les angles de liaison C-C-C-C sont tous trop petits.
- Tous les atomes de carbone du cyclopropane semblent être tétraédriques.
- Ces angles de liaison devraient être de 109 degrés.
- Les angles dans un triangle équilatéral sont en fait de 60 degrés, environ la moitié de l'angle optimal.
- Ce facteur introduit une énorme quantité de contrainte dans la molécule, appelée tension annulaire (de cycle).
Cyclobutane
Le cyclobutane est un anneau à quatre membres. En deux dimensions, c'est un carré, avec des angles de 90 degrés à chaque coin.
Cependant, en trois dimensions, le cyclobutane est suffisamment souple pour se déformer en forme de "papillon", ce qui soulage un peu la torsion. Lorsque cela se produit, les angles d'adhérence se détériorent un peu, passant de 90 degrés à 88 degrés.
Dans un dessin au trait, cette forme de papillon est habituellement représentée de profil, les bords rapprochés étant dessinés à l'aide de lignes plus foncées.
- Avec des angles de liaison de 88 au lieu de 109 degrés, le cyclobutane a beaucoup de tension annulaire, mais moins que dans le cyclopropane.
- La contrainte de torsion est toujours présente, mais les liens voisins ne sont pas exactement éclipsés dans le papillon.
- Le cyclobutane n'est toujours pas assez gros pour que la molécule puisse atteindre les alentours et provoquer un encombrement. La tension stérique est très faible.
- Les cyclobutanes sont un peu plus stables que les cyclopropanes et sont aussi un peu plus communs dans la nature.
Cyclopentane
Les cyclopentanes sont encore plus stables que les cyclobutanes et constituent le deuxième cycle paraffinique le plus courant dans la nature, après les cyclohexanes. En deux dimensions, un cyclopentane semble être un pentagone régulier.
En trois dimensions, il y a suffisamment de liberté de rotation pour permettre une légère torsion de cette forme plane. Dans un dessin au trait, cette forme tridimensionnelle est dessinée à partir d'une vue oblique, tout comme le cyclobutane.
- L'angle idéal dans un pentagone régulier est d'environ 107 degrés, très proche d'un angle de liaison tétraédrique.
- Le cyclopentane ne se déforme que très légèrement en une forme "d'enveloppe" dans laquelle un coin du pentagone est soulevé au-dessus du plan des quatre autres et, par conséquent, la déformation annulaire est entièrement éliminée.
- L'enveloppe élimine les contraintes de torsion sur les côtés et le rabat de l'enveloppe. Cependant, les charbons voisins sont éclipsés le long du "fond" de l'enveloppe, à l'écart du rabat. Il y a encore des déformations en torsion dans le cyclopentane.
- Encore une fois, il n'y a pas de contrainte stérique dans ce système.