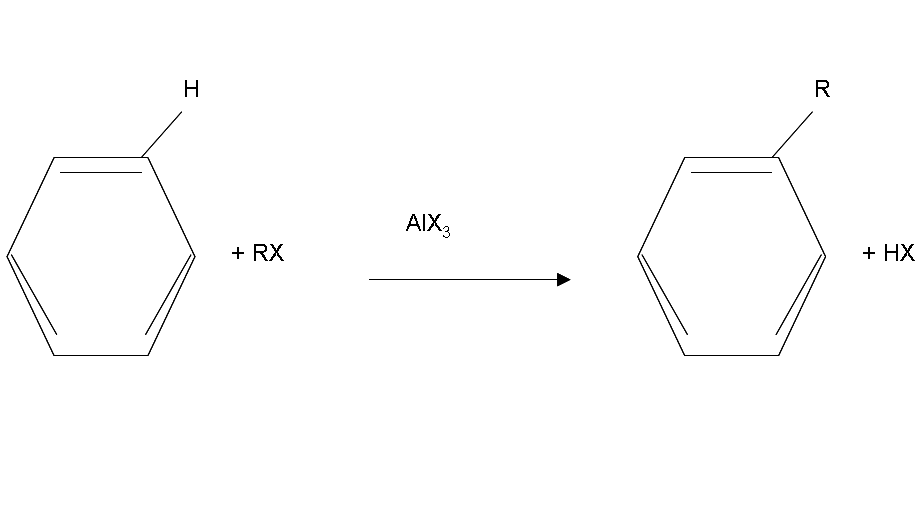
4.5: Alkylation de Friedel-Crafts
- Page ID
- 126940
Alkylation de Friedel-Crafts
Friedel-Crafts Alkylation a été découvert pour la première fois par le scientifique français Charles Friedel et son partenaire, le scientifique américain James Crafts, en 1877. Cette réaction a permis la formation d'alkylbenzènes à partir d'halogénures d'alkyle, mais elle a été affectée par une activité supplémentaire indésirable qui a réduit son efficacité.
Le mécanisme se déroule comme suit :
Première étape :
1.bmp?revision=1)
La première étape crée une cabocation qui agit comme l'électrophile dans la réaction. Cette étape active l'haloalcane. Les halogénures secondaires et tertiaires ne forment que la cabocation libre dans l'étape.
Deuxième étape:
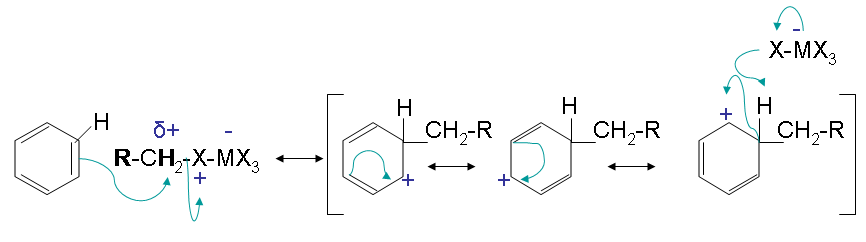
La deuxième étape consiste en une attaque électrophilique sur le benzène qui provoque de multiples formes de résonance. L'halogène réagit avec l'intermédiaire et capte l'hydrogène pour éliminer la charge positive.
Finition:
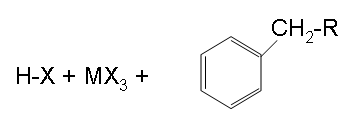
L'étape finale montrée ci-dessus est le résultat de la fin de l'étape et montre les produits finaux.
La réactivité des haloalcanes augmente à mesure que vous montez dans le tableau périodique et augmentez la polarité. Cela signifie qu'un haloalcane RF est le plus réactif suivi de RCl puis RBr et enfin RI. Cela signifie que les acides de Lewis utilisés comme catalyseurs dans les réactions d'alkylation de Friedel-Crafts ont tendance à avoir des combinaisons d'halogènes similaires telles que BF3, SbCl5, AlCl3, SbCl5, et AlBr3, qui sont toutes couramment utilisées dans ces réactions.
Quelques limites de l'alkylation de Friedel-Crafts
Il existe des possibilités de réarrangements de carbocation lorsque vous essayez d'ajouter une chaîne de carbone supérieure à deux carbones. Les réarrangements se produisent en raison des décalages d'hydrure et des décalages de méthyle. Par exemple, le produit d'une alkylation de Friedel-Crafts montrera un réarrangement iso lors de l'ajout d'une chaîne à trois atomes de carbone comme substituant. De plus, la réaction ne fonctionnera que si l'anneau auquel vous ajoutez un substituant n'est pas désactivé. Pour voir les substituants qui activent ou désactivent les anneaux de benzène.
Les trois principales limites de l'alkylation de Friedel-Crafts sont :
- Réarrangement de la carbocation - Seuls certains alkylbenzènes peuvent être fabriqués en raison de la tendance des cations à se réarranger.
- Limites des composés - Friedel-Crafts échoue lorsqu'il est utilisé avec des composés tels que le nitrobenzène et d'autres systèmes désactivants puissants.
- Polyalkylation - Les produits de Friedel-Crafts sont encore plus réactifs que la matière première. Les groupes alkyles produits dans Friedel-Crafts L'alkylation est un substituant donneur d'électrons, ce qui signifie que les produits sont plus sensibles aux attaques électrophiles que ce avec quoi nous avons commencé. Pour des raisons synthétiques, il s'agit d'une grande déception.
Pour remédier à ces limites, une réaction nouvelle et améliorée a été mise au point : L'acylation de Friedel-Crafts. (aussi connu sous le nom de Friedel-Crafts Alkanoylation).
Acylation de Friedel-Crafts
Le but de la réaction est le suivant :
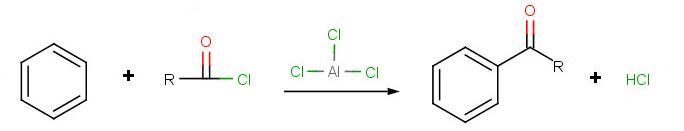.jpg?revision=1)
La toute première étape implique la formation de l'ion acylium qui réagira plus tard avec le benzène :
La deuxième étape implique l'attaque de l'ion acylium sur le benzène en tant que nouvel électrophile pour former un complexe :
.jpg?revision=1)
La troisième étape implique le départ du proton pour que l'aromaticité retourne au benzène :
Au cours de la troisième étape, AlCl4 revient pour retirer un proton du cycle benzénique, ce qui permet à ce dernier de retrouver son aromaticité. Ainsi, l'AlCl3 d'origine est régénéré pour une nouvelle utilisation avec le HCl. Plus important encore, nous avons la première partie du produit final de la réaction, qui est une cétone. La première partie du produit est le complexe avec du chlorure d'aluminium, comme illustré :
.jpg?revision=1)
L'étape finale consiste à ajouter de l'eau pour libérer le produit final sous forme d'acylbenzène :
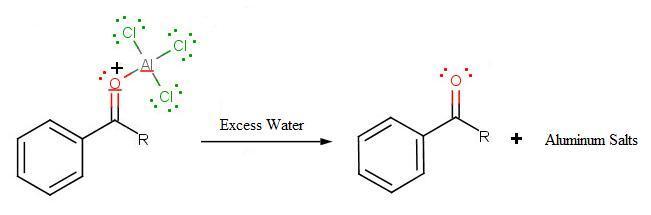.jpg?revision=1)
Comme l'ion acylium (comme on l'a montré à la première étape) est stabilisé par résonance, aucun réarrangement n'a lieu (Limitation 1). De plus, en raison de la désactivation du produit, il n'est plus sensible à l'attaque électrophilique et n'est donc plus sensible à l'attaque électrophilique et, par conséquent, ne subit plus de réactions (Limitation 3). Cependant, comme tout n'est pas parfait, la Limitation 2 prévaut toujours là où l'acylation de Friedel-Crafts échoue avec de forts anneaux de désactivation.


.jpg?revision=1&size=bestfit&width=720&height=114)
.jpg?revision=1)