2.1: Structure du groupe carbonyl
- Page ID
- 126878
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Un groupe carbonyle est un groupe fonctionnel chimiquement organique composé d'un atome de carbone doublement lié à un atome d'oxygène -->[C=O] Les groupes carbonyle les plus simples sont les aldéhydes et les cétones généralement fixés à un autre composé carboné. Ces structures se retrouvent dans de nombreux composés aromatiques contribuant à l'odeur et au goût.
Le groupe carbonyle
C=O est sujet aux additions et aux attaques nucléophiles à cause de la charge positive du carbone et de la charge négative de l'oxygène. La résonance de la charge positive partielle de carbone permet à la charge négative sur le nucléophile d'attaquer le groupe carbonyle et de devenir une partie de la structure et une charge positive (généralement un proton hydrogène) attaque l'oxygène. Pour rappel, le nucléophile est un bon acide et donc "aime les protons" pour attaquer le côté avec une charge positive.
Avant d'examiner en détail la réactivité des aldéhydes et des cétones, nous devons regarder en arrière et nous rappeler à quoi ressemble l'image de la liaison dans un carbonyle. Les carbonylcarbones sont hybrides sp2, les trois orbitales sp2 formant des chevauchements avec les orbitales sur l'oxygène et sur les deux atomes de carbone ou d'hydrogène. Ces trois liaisons adoptent une géométrie planaire trigonale. L'orbitale 2p non hybridée restante sur le carbone carbonyle central est perpendiculaire à ce plan et forme une liaison pi " côte à côte " avec une orbitale 2p sur l'oxygène.
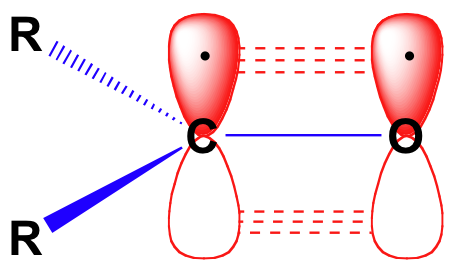
La double liaison carbone-oxygène est polaire : l'oxygène est plus électronégatif que le carbone, donc la densité des électrons est plus élevée du côté oxygène de la liaison et plus faible du côté carbone. Rappelons que la polarité de liaison peut être représentée par une flèche dipôle, ou en montrant l'oxygène comme maintenant une charge négative partielle et le carbone carbonyle une charge positive partielle.

Une troisième façon d'illustrer le dipôle carbone-oxygène est de considérer les deux principaux contributeurs de résonance d'un groupe carbonyle : la forme principale, qui est ce que l'on voit généralement dessinée dans les structures de Lewis, et un contributeur mineur mais très important dans lequel les deux électrons du pbond sont localisés sur l'oxygène, lui donnant une pleine charge négative. Cette dernière représentation montre le carbone avec une orbite vide de 2p et une charge positive pleine.
Aldéhydes
Dans les aldéhydes, le groupe carbonyle est lié à un atome d'hydrogène avec soit un second atome d'hydrogène, soit, plus communément, un groupe hydrocarboné qui peut être un groupe alkyle ou contenant un cycle benzénique. Aux fins de la présente section, nous ne tiendrons pas compte de celles qui contiennent des noyaux benzéniques.
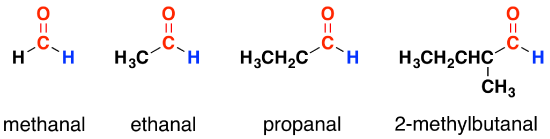
Notez que ceux-ci ont tous exactement la même extrémité à la molécule. Tout ce qui diffère, c'est la complexité de l'autre groupe. Lorsque vous écrivez des formules pour ceux-ci, le groupe aldéhyde (le groupe carbonyle avec l'atome d'hydrogène attaché) est toujours écrit comme -CHO - jamais comme COH. On pourrait facilement le confondre avec un alcool. Ethanal, par exemple, s'écrit CH3CHO ; méthanal comme HCHO. Le nom compte le nombre total d'atomes de carbone dans la chaîne la plus longue - y compris celle du groupe carbonyle. Si vous avez des groupes latéraux attachés à la chaîne, notez que vous comptez toujours de l'atome de carbone dans le groupe carbonyle comme étant le numéro 1.
Cétones
Dans les cétones, le groupe carbonyle est lié à deux groupes hydrocarbonés. Là encore, il peut s'agir soit de groupes alkyles, soit de groupes contenant des cycles benzéniques. Encore une fois, nous nous concentrerons sur ceux qui contiennent des groupes alkyles, simplement pour que les choses restent simples. Notez que les cétones n'ont jamais un atome d'hydrogène attaché au groupe carbonyle.

Le propanone s'écrit normalement CH3COCH3. Notez la nécessité de numéroter les cétones les plus longues. Dans la pentanone, le groupe carbonyle pourrait se trouver au milieu de la chaîne ou à côté de la fin - donnant soit le pentan-3-one ou le pentan-2-one..
Liaison et réactivité
L'oxygène est beaucoup plus électronégatif que le carbone et a donc une forte tendance à attirer les électrons dans une liaison carbone-oxygène vers lui-même. L'une des deux paires d'électrons qui forment une double liaison carbone-oxygène est encore plus facilement attirée vers l'oxygène. Cela rend la double liaison carbone-oxygène très polaire.
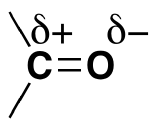
L'atome de carbone légèrement positif du groupe carbonyle peut être attaqué par les nucléophiles. Un nucléophile est un ion chargé négativement (par exemple, un ion cyanure, CN-), ou une partie légèrement chargée négativement d'une molécule (par exemple, la paire unique sur un atome d'azote dans l'ammoniac, NH3).
Pendant la réaction, la double liaison carbone-oxygène se rompt. L'effet net de tout cela est que le groupe carbonyle subit des réactions d'addition, souvent suivies par la perte d'une molécule d'eau. Il en résulte une réaction connue sous le nom d'élimination par addition ou condensation. Vous trouverez des exemples de réactions d'addition simples et d'élimination d'addition si vous explorez le menu aldéhydes et cétones (lien au bas de la page). Les aldéhydes et les cétones contiennent tous deux un groupe carbonyle. Cela signifie que leurs réactions sont très similaires à cet égard.
OÙ LES ALDÉHYDES ET LES CÉTONES DIFFÈRENT
Un aldéhyde diffère d'une cétone en ayant un atome d'hydrogène attaché au groupe carbonyle. Cela rend les aldéhydes très faciles à oxyder. Par exemple, l'éthanal, CH3CHO, s'oxyde très facilement en acide éthanoïque, CH3COOH, ou en ions éthanoate, CH3COO-.
Les cétones n'ont pas cet atome d'hydrogène et sont résistantes à l'oxydation. Ils ne sont oxydés que par de puissants agents oxydants qui ont la capacité de rompre les liaisons carbone-carbone. L'oxydation des aldéhydes et des cétones est abordée si vous suivez un lien à partir du menu aldéhydes et cétones (voir le bas de cette page).
Points d'ébullition
Le méthanal est un gaz (point d'ébullition -21°C) et l'éthanal a un point d'ébullition de +21°C. Cela signifie que l'éthanal bout à une température proche de la température ambiante. Les autres aldéhydes et les cétones sont liquides, les points d'ébullition augmentant à mesure que les molécules grossissent. La taille du point d'ébullition est déterminée par la force des forces intermoléculaires.
- Forces de dispersion de Van der Waals : Ces attraits deviennent plus forts à mesure que les molécules s'allongent et ont plus d'électrons. Cela augmente la taille des dipôles temporaires qui sont mis en place. C'est pourquoi les points d'ébullition augmentent à mesure que le nombre d'atomes de carbone dans les chaînes augmente, qu'il s'agisse d'aldéhydes ou de cétones.
- Van der Waals dipôle-dipôle attractions : Les aldéhydes et les cétones sont des molécules polaires en raison de la présence de la double liaison carbone-oxygène. En plus des forces de dispersion, il y aura aussi des attractions entre les dipôles permanents sur les molécules voisines. Cela signifie que les points d'ébullition seront plus élevés que ceux d'hydrocarbures de taille similaire - qui n'ont que des forces de dispersion. Il est intéressant de comparer trois molécules de taille similaire. Ils ont des longueurs similaires et un nombre d'électrons similaire (mais non identique).
| molécule | type | point d'ébullition (°C) |
|---|---|---|
| CH3CH2CH3 | alkane | -42 |
| CH3CHO | aldéhyde | +21 |
| CH3CH2OH | alcool | +78 |
Notez que l'aldéhyde (avec attraction dipôle-dipôle et forces de dispersion) a un point d'ébullition plus élevé que l'alcane de taille similaire qui a seulement des forces de dispersion. Cependant, le point d'ébullition de l'aldéhyde n'est pas aussi élevé que celui de l'alcool. Dans l'alcool, il y a la liaison hydrogène ainsi que les deux autres types d'attraction intermoléculaire
Solubilité dans l'eau
Les petits aldéhydes et cétones sont facilement solubles dans l'eau, mais leur solubilité diminue avec la longueur de la chaîne. Par exemple, le méthanal, l'éthanal et le propanone - les petits aldéhydes et cétones courants - sont miscibles à l'eau dans toutes les proportions, car bien que les aldéhydes et cétones ne puissent se lier à eux-mêmes, ils peuvent se lier à l'hydrogène avec les molécules d'eau, ce qui explique cette solubilité. L'un des atomes d'hydrogène légèrement positifs d'une molécule d'eau peut être suffisamment attiré par l'une des paires isolées de l'atome d'oxygène d'un aldéhyde ou d'une cétone pour former une liaison hydrogène.
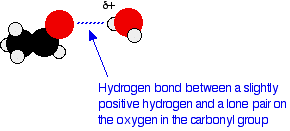
Il y aura aussi, bien sûr, des forces de dispersion et des attractions dipôles-dipôles entre l'aldéhyde ou la cétone et les molécules d'eau. La formation de ces attractions libère de l'énergie qui aide à fournir l'énergie nécessaire pour séparer les molécules d'eau et les molécules d'aldéhyde ou de cétone les unes des autres avant qu'elles puissent se mélanger.
Au fur et à mesure que la longueur des chaînes augmente, les "queues" d'hydrocarbures des molécules (tous les fragments d'hydrocarbures à l'exception du groupe carbonyle) commencent à se mettre en travers de la route. En se forçant entre les molécules d'eau, ils brisent les liaisons hydrogène relativement fortes entre les molécules d'eau sans les remplacer par rien d'aussi bon. Cela rend le procédé énergétiquement moins rentable, et donc la solubilité diminue.

