4.6: Activation ou désactivation par des substituants sur un anneau de benzène
- Page ID
- 126945
Les anneaux substitués sont divisés en deux groupes selon le type de substituant que porte l'anneau :
- Anneaux activés : les substituants de l'anneau sont des groupes qui donnent des électrons.
- Anneaux désactivés : les substituants de l'anneau sont des groupes qui retirent des électrons.
Introduction
Exemples d'activation de groupes dans l'ordre relatif du groupe le plus actif au groupe le moins actif :
-NH2, -NR2 > -OH, -OR> -NHCOR> -CH3 and other alkyl groups
avec R comme groupes alkyle (CnH2n+1)
Exemples de désactivation de groupes dans l'ordre relatif du plus désactivant au moins désactivant :
-NO2, -CF3> -COR, -CN, -CO2R, -SO3H > Halogens
avec R comme groupes alkyle (CnH2n+1)
L'ordre de réactivité entre les halogènes va de l'halogène le plus réactif (substituant le moins désactivant) au moins réactif (substituant le plus désactivant) :
F> Cl > Br > I
L'ordre de réactivité des anneaux benzéniques vis-à-vis de la substitution électrophilique lorsqu'ils sont substitués par un halogène, suit l'ordre de l'électronégativité. Le cycle qui est substitué par l'halogène le plus électronégatif est le cycle le plus réactif ("substituant moins désactivant") et le cycle qui est substitué par l'halogène le moins électronégatif est le cycle le moins réactif ("substituant plus désactivant"), quand on compare les cycles avec des substituants halogénés. La taille de l'halogène influe également sur la réactivité du cycle benzénique auquel l'halogène est fixé. Lorsque la taille de l'halogène augmente, la réactivité de l'anneau diminue.
La direction de la réaction
Le groupe d'activation dirige la réaction vers la position ortho ou para, ce qui signifie que l'électrophile remplace l'hydrogène qui est sur le carbone 2 ou le carbone 4. Le groupe désactivant dirige la réaction vers la position méta, ce qui signifie que l'électrophile substitue l'hydrogène qui est sur le carbone 3 à l'exception des halogènes qui est un groupe désactivant mais dirige la substitution ortho ou para.
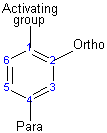
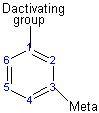
Les substituts déterminent la direction de réaction par résonance ou effet inductif.
L'effet de résonance est la conjugaison entre l'anneau et le substituant, ce qui signifie la délocalisation des électrons \(\pi\) entre l'anneau et le substituant. L'effet inductif est le retrait des électrons sigma ("single bond") de l'anneau vers le substituant, en raison de la plus grande électronégativité du substituant par rapport au carbone de l'anneau.
Activation de groupes (directeurs ortho ou para)
Lorsque les substituants comme -OH ont une paire d'électrons non partagée, l'effet de résonance est plus fort que l'effet inductif qui rend ces substituants plus forts activateurs, puisque cet effet de résonance dirige l'électron vers le cycle. Dans les cas où les substituants sont des esters ou des amides, ils sont moins activants parce qu'ils forment une structure de résonance qui éloigne la densité électronique du noyau.
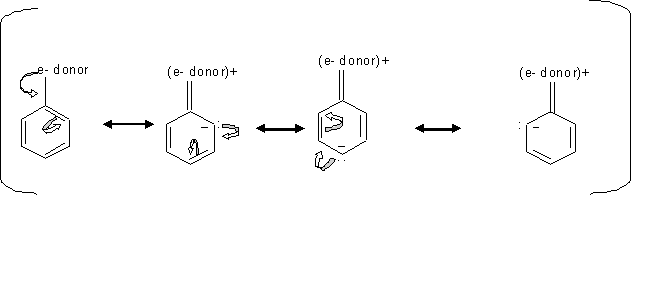
En examinant le mécanisme ci-dessus, nous pouvons voir comment les groupes qui donnent des électrons dirigent la sous-stition ortho, paraélectrophile. Depuis que les électrons localisent le transfert entre les carbones ortho et para, alors l'électrophile préfère attaquer le carbone qui a l'électron libre.
L'effet inductif des groupes alkyles active la direction de la substitution ortho ou para, c'est-à-dire quand les électrons s sont poussés vers l'anneau.
Désactiver le groupe (meta directeurs)
Les groupes désactivants désactivent l'anneau par effet inductif en présence d'un atome électronégatif qui retire les électrons de l'anneau.
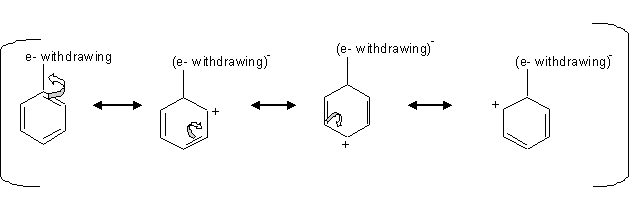
nous pouvons voir par le mécanisme ci-dessus que lorsqu'il y a un électron retiré de l'anneau, cela laisse les carbones aux positions ortho, para avec une charge positive qui est défavorable pour l'électrophile, donc l'électrophile attaque le carbone aux positions meta.
Les halogènes sont une exception du groupe désactivant qui dirige la substitution ortho ou para. Les halogènes désactivent l'anneau par effet inductif et non par résonance même s'ils ont une paire d'électrons non appariés. La paire d'électrons non appariés est donnée à l'anneau, mais l'effet inductif tire les électrons s de l'anneau par l'électronégativité des halogènes.
Les substituants déterminent la réactivité des anneaux
La réaction d'un cycle substitué avec un groupe activateur est plus rapide que celle du benzène. Par contre, un cycle substitué par un groupe désactivé est plus lent que le benzène.
L'activation des groupes accélère la réaction en raison de l'effet de résonance. La présence des électrons non appariés qui peuvent être donnés à l'anneau, stabilise la carbocation dans l'état de transition. Ainsi, la stabilisation de l'étape intermédiaire, accélère la réaction ; et cela est dû à la diminution de l'énergie d'activation. D'autre part, les groupes désactivants retirent les électrons de la carbocation formée dans l'étape intermédiaire, ce qui augmente l'énergie d'activation et ralentit la réaction.
Le CH3 Group est et ortho, para Directeur
Les groupes alkyles sont des activateurs inductifs.
Avec o/p attaque la forme d'une carbocation tertiaire de l'arène qui accélère la réaction.
Le Groupe O-CH3 est un ortho, para Directeur
Ortho and Para producst produit une structure de résonance qui stabilise l'ion arénium. Les produits ortho et para se forment ainsi plus rapidement que les méta. Généralement, le produit para est préféré en raison des effets stériques.
Les groupes Acyl sont des méta-directeurs
Les groupes acyles sont des désactivateurs de résonance. L'attaque ortho et para produit une structure de résonance qui place le cation arénium à côté du cation arérien et du cation additionnel. Ceci déstabilise le cation de l'arénium et ralentit la réaction ortho et para. Par défaut, le méta produit se forme plus rapidement parce qu'il n'a pas cette structure de résonance déstabilisante.
References
- Schore, N.E. and P.C. Vollhardt. 2007. Organic Chemistry, structure and function, 5th ed. New York,NY: W.H. Freeman and Company.
- Fryhle, C.B. and G. Solomons. 2008. Organic Chemistry, 9th ed.Danvers,MA: Wiley.

