3.2: Caractère nucléophile de la liaison Pi : Addition électrophile d'halogénures d'hydrogène
- Page ID
- 126886
Addition aux alcènes symétriques
Tous les alcènes subissent des réactions d'addition avec les halogénures d'hydrogène. Un atome d'hydrogène se joint à l'un des atomes de carbone à l'origine dans la double liaison, et un atome d'halogène à l'autre.
Par exemple, avec l'éthène et le chlorure d'hydrogène, on obtient du chloroéthane:
![]()
![]()
Avec le but-2-ène, vous obtenez du 2-chlorobutane:
![]()
![]()
Que se passe-t-il si vous ajoutez l'hydrogène à l'atome de carbone à l'extrémité droite de la double liaison et le chlore à l'extrémité gauche ? Vous auriez toujours le même produit. Le chlore serait sur un atome de carbone à côté de la fin de la chaîne - vous auriez simplement dessiné la molécule retournée dans l'espace. Ce serait différent si l'alcène était asymétrique - c'est pourquoi nous devons les examiner séparément.
Mécanisme
L'addition d'halogénures d'hydrogène est l'une des réactions d'addition électrophiles les plus faciles car elle utilise le plus simple des électrophile : le proton. Les halogénures d'hydrogène fournissent à la fois un électrophile (proton) et un nucléophile (halogénure). Tout d'abord, l'électrophile attaquera la double liaison et prendra un ensemble d'électrons π, l'attachant à la molécule (1). C'est essentiellement l'inverse de la dernière étape de la réaction E1 (étape de déprotonation). La molécule résultante aura une simple liaison carbone-carbone avec une charge positive sur l'une d'elles (carbocation). L'étape suivante est lorsque le nucléophile (halogénure) se lie à la carbocation, produisant une nouvelle molécule avec l'hydrogène et l'halogénure originaux fixés au réactif organique (2). La deuxième étape ne se produira que si un bon nucléophile est utilisé.
Mécanisme d'addition électrophile d'halogénure d'hydrogène à l'éthène
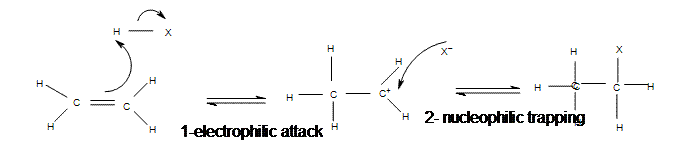
Mécanisme d'addition électrophile d'halogénure d'hydrogène au propène
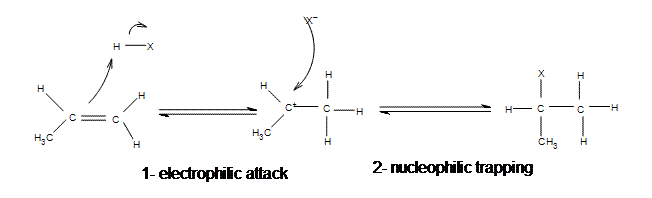
Tous les halogénures (HBr, HCl, HI, HF) peuvent participer à cette réaction et s'ajouter de la même manière. Bien que les différents halogénures aient des vitesses de réaction différentes, la liaison H-X s'affaiblit à mesure que X s'élargit (faible chevauchement des orbitales).
Reaction rates
Variation des taux lorsque vous changez d'halogène
Les taux de réaction augmentent dans l'ordre HF - HCl - HBr - HI. Le fluorure d'hydrogène réagit beaucoup plus lentement que les trois autres et il est normalement ignoré lorsqu'on parle de ces réactions.
Lorsque les halogénures d'hydrogène réagissent avec les alcènes, la liaison hydrogène-halogène doit être rompue. La force de liaison diminue au fur et à mesure que l'on passe de HF à HI, et la liaison hydrogène-fluor est particulièrement forte. Comme il est difficile de rompre la liaison entre l'hydrogène et le fluor, l'addition de HF est forcément lente.
Variation des taux lorsque vous changez d'alcène
Ceci s'applique aussi bien aux alcènes asymétriques qu'aux alcènes symétriques. Pour des raisons de simplicité, les exemples donnés ci-dessous sont tous symétriques, mais ils n'ont pas à l'être.
Les taux de réaction augmentent à mesure que l'alcène se complique - dans le sens du nombre de groupes alkyle (tels que les groupes méthyle) fixés aux atomes de carbone à chaque extrémité de la double liaison. Par exemple:
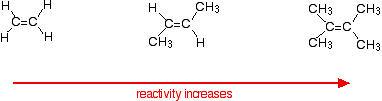
Il y a deux façons d'examiner les raisons de cette situation - les deux nécessitent que vous connaissiez le mécanisme des réactions.
Les alcènes réagissent parce que les électrons dans la liaison pi attirent les choses avec n'importe quel degré de charge positive. Tout ce qui augmente la densité d'électrons autour de la double liaison y contribuera.
Les groupes alkyles ont tendance à "repousser" les électrons d'eux-mêmes vers la double liaison. Plus vous avez de groupes alkyles, plus la zone autour des doubles liaisons devient négative.
Plus cette région est chargée négativement, plus elle attirera des molécules comme le chlorure d'hydrogène.
La raison la plus importante, cependant, réside dans la stabilité de l'ion intermédiaire formé pendant la réaction. Les trois exemples donnés ci-dessus produisent ces carbocations (ions carbonium) à mi-chemin de la réaction :
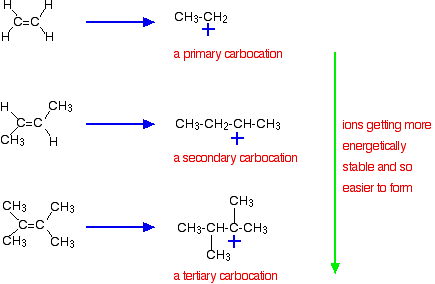
La stabilité des ions intermédiaires régit l'énergie d'activation de la réaction. Au fur et à mesure que vous vous dirigez vers les alcènes plus complexes, l'énergie d'activation de la réaction diminue. Cela signifie que les réactions deviennent plus rapides.
Addition d'alcènes asymétriques
Que se passe-t-il ?
En termes de conditions de réaction et de facteurs affectant les vitesses de réaction, il n'y a aucune différence entre ces alcynes et les alcynes symétriques décrits ci-dessus. Le problème vient de l'orientation de l'addition - en d'autres termes, de l'orientation de l'addition d'hydrogène et d'halogène à travers la double liaison.
Orientation de l'addition
Si le HCl s'ajoute à un alcène asymétrique comme le propène, il y a deux façons possibles de l'ajouter. Toutefois, dans la pratique, il n'existe qu'un seul produit majeur.
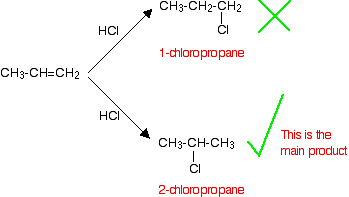
Ceci est conforme à la règle de Markovnikov qui dit :
-
Lorsqu'un composé HX est ajouté à un alcène asymétrique, l'hydrogène se fixe au carbone et la plupart des hydrogènes y sont déjà fixés.
Dans ce cas, l'hydrogène se lie au groupe CH2, car le groupe CH2 contient plus d'hydrogènes que le groupe CH. Notez que seuls les hydrogènes directement liés aux atomes de carbone à chaque extrémité de la double liaison comptent. Ceux du groupe CH3 sont totalement hors de propos.
très important en ce qui concerne les réactions d'addition électrophile est que si l'alcène de départ est asymétrique, il y a deux cours possibles qui pourraient être suivis, selon lequel des deux carbones d'alcène forme la nouvelle liaison sigma dans la première étape.
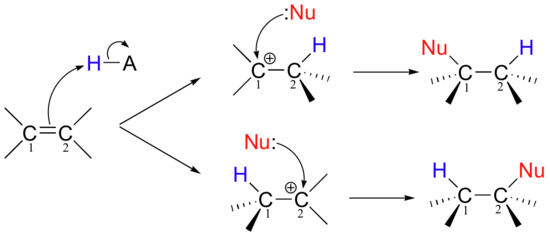
Bien sûr, les deux cours de réaction impliquent deux intermédiaires de carbocation différents, qui peuvent avoir des niveaux d'énergie différents. Deux produits différents sont possibles, et en général le produit qui prédomine sera celui qui est dérivé de l'intermédiaire de carbocation à basse énergie.
Ce principe régiochimique important est bien illustré par un simple ajout électrophilique qui est couramment effectué dans le laboratoire organique : la conversion d'un alcène en bromure d'alkyle par addition électrophilique de HBr à la double liaison. Examinons une addition hypothétique de HBr au 2-méthyl-2-butène, illustrée ci-dessous. Deux résultats régiochimiques différents sont possibles :
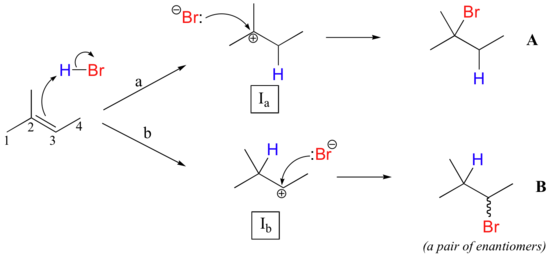
L'étape de protonation initiale pourrait suivre deux voies différentes, donnant lieu à deux intermédiaires de carbocation différents : la voie " a " donne un intermédiaire de carbocation tertiaire (Ia), tandis que la voie " b " donne un intermédiaire de carbocation secondaire (Ib) Nous savons déjà que la carbocation tertiaire est plus stable (c'est-à-dire moins énergétique). Selon le postulat de Hammond, cela implique que l'énergie d'activation de la voie a est inférieure à celle de la voie b, ce qui signifie que Ia se forme plus rapidement.
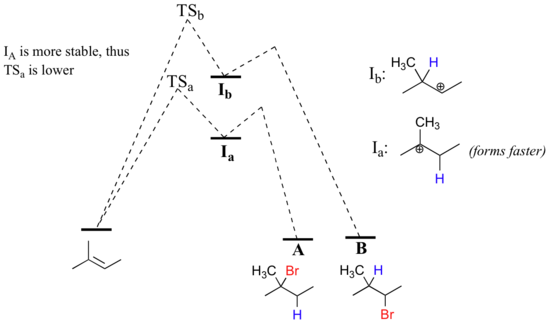
Comme l'étape de protonation est l'étape de détermination de la vitesse de la réaction, le bromure d'alkyle tertiaire A se formera beaucoup plus rapidement que l'halogénure d'alkyle secondaire B, et A sera donc le produit prédominant observé dans cette réaction. Il s'agit d'un bon exemple de réaction organique non enzymatique très spécifique à la région.
Dans l'exemple ci-dessus, la différence de stabilité de carbocation peut être expliquée par les effets donneurs d'électrons du groupe méthyle supplémentaire sur un côté de la double liaison. On observe généralement que, dans l'addition électrophile d'acides (y compris l'eau) à des alcènes asymétriques, plus le carbone substitué est celui qui est lié à l'hétéroatome de l'acide, tandis que le carbone moins substitué est protoné.
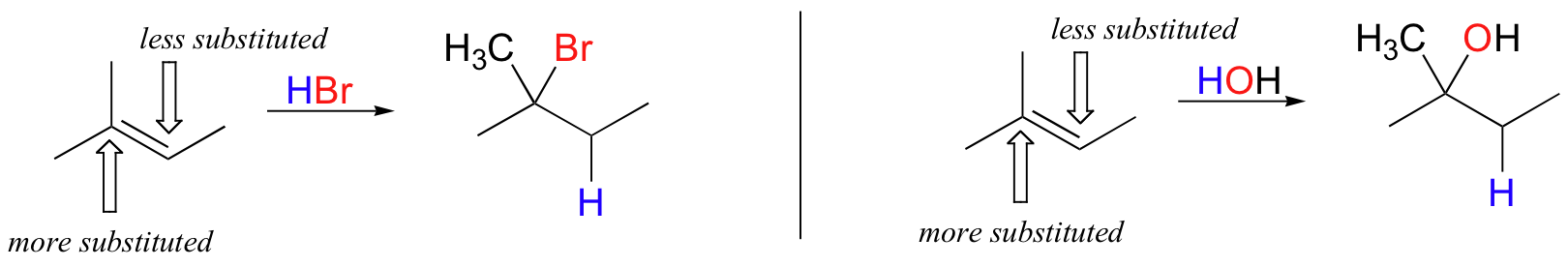
Cette règle empirique est connue sous le nom de règle de Markovnikov, du nom du chimiste russe Vladimir Markovnikov qui l'a proposée en 1869.
Bien qu'elle soit utile dans de nombreux cas, la règle de Markovikov ne s'applique pas à toutes les additions électrophiles possibles. Il est plus exact d'utiliser le principe plus général qui a déjà été énoncé ci-dessus :
Lorsqu'un alcène asymétrique subit une addition électrophilique, le produit qui prédomine est celui qui résulte du plus stable des deux intermédiaires de carbocation possibles.
En quoi est-ce différent de la règle originale de Markovnikov ? Considérons la réaction hypothétique suivante, qui est semblable à l'addition de HBr montrée ci-dessus, sauf que les six hydrogènes méthyliques du côté gauche de la double liaison ont été remplacés par des fluorines à fort pouvoir attracteur d'électrons.
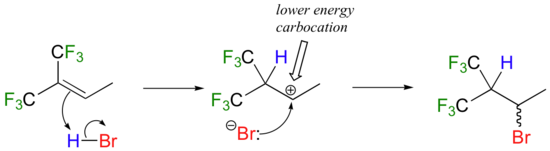
Maintenant, lorsque HBr est ajouté, c'est la carbocation la moins substituée qui se forme plus rapidement dans l'étape de détermination de la vitesse de protonation, parce que dans cet intermédiaire le carbone portant la charge positive est situé plus loin des fluorines qui attirent les électrons et déstabilisent les cations. Par conséquent, le produit prédominant est le bromoalcane secondaire plutôt que tertiaire. Il s'agirait d'un produit d'addition " anti-Markovnikov ", parce qu'il " enfreint " la règle de Markovnikov.

