1.2: Puissance de l'acide et de la base
- Page ID
- 126872
Vous savez sans doute que certains acides sont plus forts que d'autres. L'acide sulfurique est assez fort pour être utilisé comme nettoyant de drain, car il dissout rapidement les bouchons de cheveux et autres matières organiques.
Il n'est pas surprenant que l'acide sulfurique concentré cause aussi des brûlures douloureuses s'il touche votre peau et des dommages permanents s'il pénètre dans vos yeux (il y a une bonne raison pour les lunettes de sécurité que vous portez dans un laboratoire de chimie). L'acide acétique (vinaigre), brûle aussi la peau et les yeux, mais n'est pas assez fort pour faire un nettoyant de drain efficace. L'eau, dont nous savons qu'elle peut agir comme donneur de protons, n'est évidemment pas un acide très fort. Même l'ion hydroxyde pourrait théoriquement agir comme un acide - il a, après tout, un proton à donner - mais ce n'est pas une réaction que nous considérerions normalement comme pertinente dans des conditions autres que les plus extrêmes.
L'acidité relative de différents composés ou groupes fonctionnels, c'est-à-dire leur capacité relative à donner un proton à une base commune dans des conditions identiques, est quantifiée par un nombre appelé constante de dissociation, abrégée Ka. La base commune choisie pour la comparaison est l'eau.
Nous allons considérer l'acide acétique comme notre premier exemple. Lorsqu'une petite quantité d'acide acétique est ajoutée à l'eau, un événement de transfert de protons (réaction acide-base) se produit dans une certaine mesure.
Remarquez l'expression " dans une certaine mesure " - cette réaction ne s'achève pas avec la conversion de tout l'acide acétique en acétate, sa base conjuguée. Au contraire, un équilibre dynamique est atteint, avec un transfert de protons dans les deux sens (donc les flèches à double sens) et des concentrations finies des quatre espèces en jeu. La nature de cette situation d'équilibre, comme vous vous en souvenez en chimie générale, est exprimée par une constante d'équilibre, Keq.
\[ K_{eq} = \dfrac{[CH_3COO^-][H_3O^+]}{[CH_3COOH][H_2O]}\]
Nous avons ajouté une petite quantité d'acide acétique à une grande quantité d'eau : l'eau est le solvant de cette réaction. Par conséquent, au cours de la réaction, la concentration en eau (environ 55,6 mol/L) change très peu et peut être considérée comme constante. La constante de dissociation de l'acide, ou Ka, pour l'acide acétique est définie comme suit :
\[ K_{a} = K_{eq}[H_2O] = \dfrac{[CH_3COO^-][H_3O^+]}{[CH_3COOH]} = 1.75 \times 10^{-5}\]
En termes plus généraux, la constante de dissociation pour un acide donné est exprimée en :
\[ K_a = \dfrac{[A^-][H_3O^+]}{[HA]} \label{First}\]
ou
\[ K_a = \dfrac{[A][H_3O^+]}{[HA^+]} \label{Second}\]
Équation \(\ref{First}\) s'applique à un acide neutre comme le HCl ou l'acide acétique, tandis que l'équation \(\ref{Second}\) s'applique à un acide cationique comme l'ammonium (NH4+).
La valeur de Ka = 1,75 x 10-5 pour l'acide acétique est très faible - cela signifie qu'il y a très peu de dissociation et qu'il y a beaucoup plus d'acide acétique en solution à l'équilibre qu'il y a d'ions acétate. L'acide acétique est un acide relativement faible, du moins lorsqu'on le compare à l'acide sulfurique (Ka = 109) ou à l'acide chlorhydrique (Ka = 107), qui subissent tous deux une dissociation essentiellement complète dans l'eau.
Un chiffre comme 1,75 x 10-5 n'est pas très facile à dire ou à retenir. Les chimistes ont donc trouvé un terme plus pratique pour exprimer l'acidité relative : la valeur pKa.
\[pK_a = -\log K_a\]
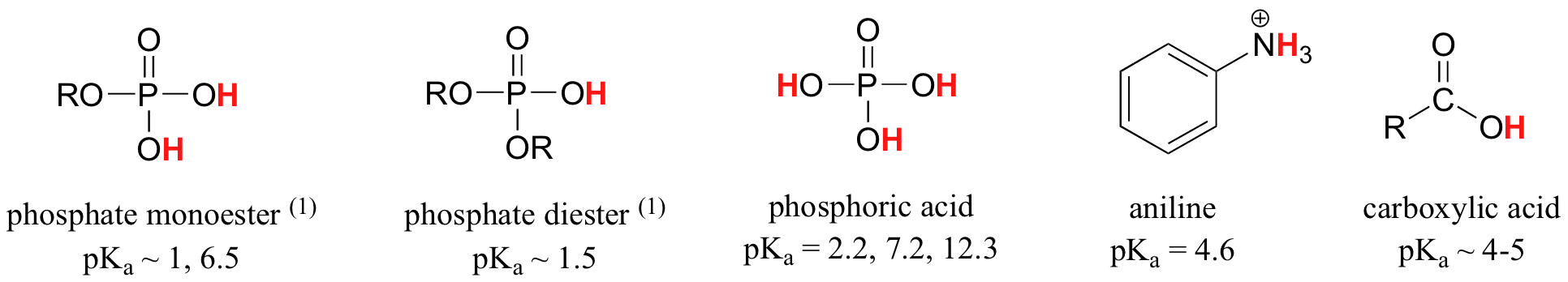
En faisant le calcul, nous constatons que le pKa de l'acide acétique est de 4,8. L'utilisation de valeurs pKa nous permet d'exprimer l'acidité de composés et de groupes fonctionnels communs sur une échelle numérique d'environ -10 (acide très fort) à 50 (pas acide du tout). Tableau \(\PageIndex{1}\) à la fin du texte énumère les valeurs exactes ou approximatives de pKa pour différents types de protons que vous êtes susceptibles de rencontrer dans votre étude de la chimie organique et biologique. En regardant Tableau \(\PageIndex{1}\), vous voyez que le pKa des acides carboxyliques est de l'ordre de 4-5, le pKa de l'acide sulfurique est de -10 et le pKa de l'eau est de 15,7. Les alcènes et alcanes, qui ne sont pas du tout acides, ont des valeurs pKa supérieures à 30. Plus la valeur pKa est faible, plus l'acide est fort.
Tableau \(\PageIndex{1}\): Constantes d'acide représentatives


Il est important de comprendre que le pKa n'est pas du tout la même chose que le pH : le premier est une propriété inhérente d'un composé ou d'un groupe fonctionnel, tandis que le second est la mesure de la concentration en ions hydronium dans une solution aqueuse particulière :
\[pH = -\log [H_3O^+]\]
Un acide particulier aura toujours le même pKa (en supposant qu'il s'agit d'une solution aqueuse à température ambiante), mais différentes solutions aqueuses de l'acide peuvent avoir des valeurs de pH différentes, selon la quantité d'acide ajoutée et la quantité d'eau.
Notre tableau des valeurs de pKa nous permettra également de comparer les concentrations de différentes bases en comparant les pKavalues de leurs acides conjugués. L'idée clé à retenir est la suivante : plus l'acide conjugué est fort, plus la base conjuguée est faible. L'acide sulfurique est l'acide le plus fort de notre liste avec une valeur pKa de -10, donc HSO4- est la base conjuguée la plus faible. Vous pouvez voir que l'ion hydroxyde est une base plus forte que l'ammoniac (NH3), car l'ammonium (NH4+, pKa = 9,2) est un acide plus fort que l'eau (pKa = 15,7).
Plus l'acide conjugué est fort, plus la base conjuguée est faible.
Tandis que le tableau \(\PageIndex{1}\) ne fournit les valeurs de pKa que d'un nombre limité de composés, il peut être très utile comme point de départ pour estimer l'acidité ou la basicité de presque toutes les molécules organiques. C'est ici que votre connaissance des groupes fonctionnels organiques vous sera très utile. Qu'est-ce que, par exemple, le pKaof cyclohexanol ? Ce n'est pas sur la table, mais comme il s'agit d'un alcool, il est probablement quelque part proche de celui de l'éthanol (pKa = 16). De même, nous pouvons utiliser Tableau \(\PageIndex{1}\) pour prédire que le para-hydroxyphénylacétaldéhyde, un composé intermédiaire dans la biosynthèse de la morphine, a un pKa de l'ordre de 10, proche de celui de notre composé de référence, le phénol.
Notez dans cet exemple que nous devons évaluer l'acidité potentielle à quatre endroits différents sur la molécule.
Les aldéhydes et les protons aromatiques ne sont pas du tout acides (les valeurs pKav sont supérieures à 40 - pas sur notre table). Les deux protons sur le carbone à côté du carbonyle sont légèrement acides, avec des valeurs de pKa autour de 19-20 selon le tableau. Le proton le plus acide est sur le groupe phénol, donc si le composé devait être soumis à un seul équivalent molaire d'une base forte, c'est le proton qui serait donné.
Tout en continuant votre étude de la chimie organique, ce sera une très bonne idée de mémoriser les intervalles pKa approximatifs de certains groupes fonctionnels importants, y compris l'eau, les alcools, les phénols, l'ammonium, les thiols, les phosphates, les acides carboxyliques et les carbones à côté des groupes carbonyle (appelés a-carbones). Ce sont les groupes les plus susceptibles d'agir comme acides ou comme bases dans les réactions organiques biologiques.
Un mot d'avertissement : lorsque vous utilisez le tableau pKa, soyez absolument certain que vous considérez la bonne paire acide conjugué/base. Si l'on vous demande de dire quelque chose sur la basicité de l'ammoniac (NH3) par rapport à celle de l'ion éthoxyde (CH3CH2O-), par exemple, les valeurs pKa à considérer sont 9,2 (le pKa de l'ion ammonium) et 16 (le pKa de l'éthanol). D'après ces chiffres, vous savez que l'éthoxyde est la base la plus solide. Ne faites pas l'erreur d'utiliser la valeur pKa de 38 : c'est le pKa de l'ammoniac qui agit comme un acide, et vous dit à quel point l'ion NH2- est fondamental (très basique !)