1.1: Acides et bases - La définition de Brønsted-Lowry
- Page ID
- 126871
Définition de Brønsted-Lowry
J.N. Brønsted et T.M. Lowry ont développé indépendamment la théorie des donneurs de protons et des accepteurs de protons dans les réactions acido-basiques, par coïncidence dans la même région et pendant la même année. La théorie d'Arrhenius où les acides et les bases sont définis par le fait que la molécule produit de l'ion hydrogène ou de l'ion hydroxyde quand elle est dissoute dans l'eau était trop restrictive, parce que toutes les réactions chimiques, surtout les réactions organiques, ne se produisent pas dans l'eau. La théorie de Brønsted-Lowry définit un acide comme donneur de protons, tandis qu'une base est un accepteur de protons. Ceci est illustré dans les réactions suivantes :
\[HCl + HOH \rightarrow H_3O^+ + Cl^-\]
\[HOH + NH_3 \rightarrow NH_4^+ + OH^-\]
|
|
|
|
|---|---|---|
| Donne des ions hydrogène (proton) |
|
|
|
|
|
H3O+ + Cl- |
|
|
|
NH4+ + OH- |
La détermination d'une substance en tant qu'acide ou base de Brønsted-Lowry ne peut se faire qu'en examinant la réaction, car de nombreux produits chimiques peuvent être soit un acide soit une base. Par exemple, HOH est une base dans la première réaction et un acide dans la deuxiéme.
Pour déterminer si une substance est un acide ou une base, compter les hydrogènes sur chaque substance avant et après la réaction. Si le nombre d'hydrogènes a diminué, alors cette substance est l'acide (donne des ions hydrogène). Si le nombre d'hydrogènes a augmenté, alors cette substance est la base (accepte les ions hydrogène). Ces définitions s'appliquent normalement aux réactifs de gauche. Si l'on observe la réaction à l'envers, on peut identifier un nouvel acide et une nouvelle base. Les substances du côté droit de l'équation sont appelées acide conjugué et base conjuguée par rapport à celles du côté gauche. Notez également qu'un acide se transforme en une base conjuguée et que la base se transforme en acide conjugué une fois la réaction terminée.
Les acides sont des donneurs de protons et les bases sont des accepteurs de protons
Pour qu'une réaction soit en équilibre, un transfert d'électrons doit se produire. L'acide donnera un électron et la base recevra l'électron. Les acides et les bases qui travaillent ensemble de cette façon sont appelés une paire conjuguée composée d'acides conjugués et de bases conjuguées.
A représente un composé acide et Z représente un composé basique.
- A Donne H pour former HZ+.
- Z Accepte H de A qui forme HZ+.
- A- devient la base conjuguée de HA et dans la réaction inverse il accepte un H de HZ pour recréer HA afin de rester en équilibre.
- HZ+ devient un acide conjugué de Z et dans la réaction inverse il donne un H à A- recréant Z pour rester en équilibre.
Dans les solutions aqueuses, les acides et les bases peuvent être définis en termes de transfert d'un proton d'un acide à une base. Ainsi, pour chaque espèce acide en solution aqueuse, il existe une espèce dérivée de l'acide par la perte d'un proton. Ces deux espèces qui ne diffèrent que par un proton constituent une paire acide-base conjuguée. Par exemple, dans la réaction du HCl avec l'eau (équation 16.1), le HCl, l'acide parent, donne un proton à une molécule d'eau, la base mère, formant ainsi Cl-. Ainsi, Cl et Cl- constituent une paire acide-base conjuguée. Par convention, nous écrivons toujours une paire acide-base conjuguée comme l'acide suivi de sa base conjuguée. Dans la réaction inverse, l'ion Cl- en solution sert de base pour accepter un proton de H3O+, formant H2O et HCl. Ainsi, H3O+ et H2O constituent une seconde paire acide-base conjuguée. En général, toute réaction acide-base doit contenir deux paires acide-base conjuguées, qui dans ce cas sont HCl/Cl- et H3O+/H2O.
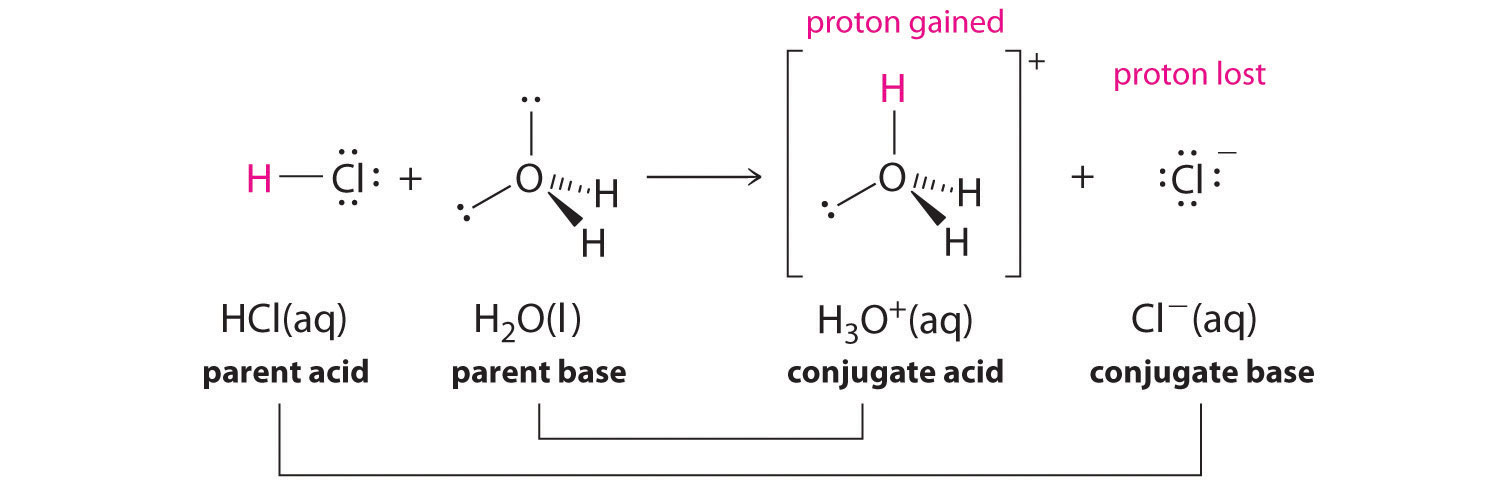
Toutes les réactions acido-basiques contiennent deux paires acide-base conjuguées.
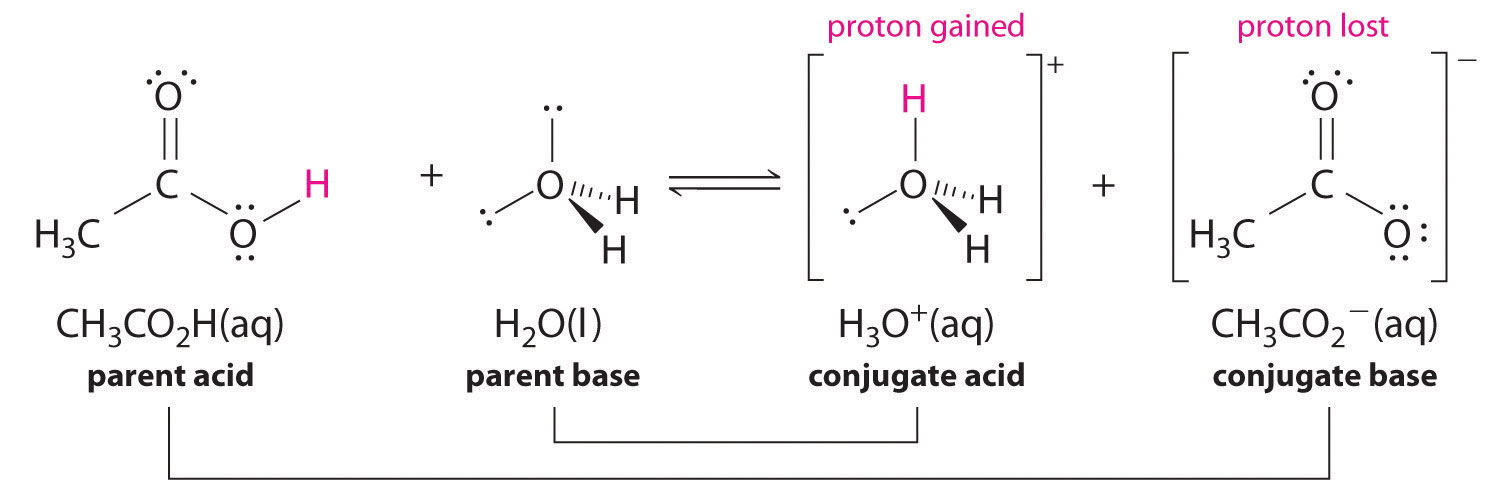
De même, dans la réaction de l'acide acétique avec l'eau, l'acide acétique donne un proton à l'eau, qui agit comme base. Dans la réaction inverse, H3O+ est l'acide qui donne un proton à l'ion acétate, qui agit comme base. Encore une fois, nous avons deux paires acides-bases conjuguées : l'acide parent et sa base conjuguée (CH3CO2H/CH3CO2-) et la base parent et son acide conjugué (H3O+/H2O).
Dans la réaction de l'ammoniac avec l'eau pour donner des ions ammonium et des ions hydroxyde (équation 16.3), l'ammoniac agit comme une base en acceptant un proton d'une molécule d'eau, ce qui dans ce cas signifie que l'eau agit comme un acide. Dans la réaction inverse, un ion ammonium agit comme un acide en donnant un proton à un ion hydroxyde, et l'ion hydroxyde agit comme une base. Les paires acides-bases conjuguées pour cette réaction sont NH4+/NH3 et H2O/OH-. La figure 2.7.1 présente quelques paires courantes de bases acides conjuguées.
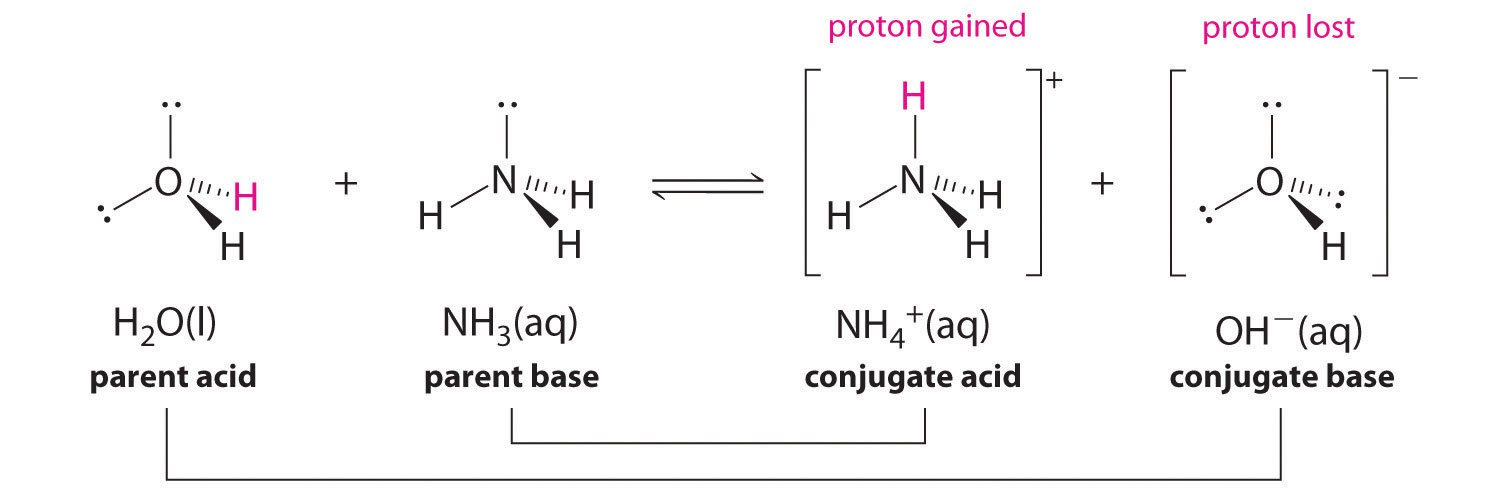
Figure 2.7.1 Pouvoirs relatifs de certaines paires courantes de bases acides conjuguées

Les acides les plus forts se trouvent en bas à gauche et les bases les plus fortes en haut à droite. La base conjuguée d'un acide fort est une base très faible et, inversement, l'acide conjugué d'une base forte est un acide très faible.

